Autor:
Eugene Taylor
Loomise Kuupäev:
12 August 2021
Värskenduse Kuupäev:
22 Juunis 2024
Sisu
- Astuda
- 1. osa 2: elemendi tavaline elektronkonfiguratsioon
- 2. osa 2: väärisgaasi elektronide konfiguratsioon
- Hoiatused
Elemendi elektronkonfiguratsiooni kirjutamine on hea viis vaadelda elektronide jaotust aatomis. Sõltuvalt elemendist võib valem olla väga pikk. Seetõttu on teadlased välja töötanud lühikirjelduse, mis kasutab väärisgaasi elektronide esindamiseks, mis ei ole valentselektronid. See lihtsustab elektronide konfiguratsiooni ja hõlbustab elemendi keemiliste omaduste mõistmist.
Astuda
1. osa 2: elemendi tavaline elektronkonfiguratsioon
 Määrake elemendis olevate elektronide arv. Elemendi aatomnumber annab teada prootonite arvu. Kuna neutraalses olekus olevatel elementidel on sama palju prootoneid ja elektrone, võite kasutada ka aatomnumbrit kui elemendis olevate elektronide arv. Perioodilisustabelist leitav aatomnumber on number otse elemendi sümboli kohal.
Määrake elemendis olevate elektronide arv. Elemendi aatomnumber annab teada prootonite arvu. Kuna neutraalses olekus olevatel elementidel on sama palju prootoneid ja elektrone, võite kasutada ka aatomnumbrit kui elemendis olevate elektronide arv. Perioodilisustabelist leitav aatomnumber on number otse elemendi sümboli kohal. - Näiteks naatriumi sümbol on Na. Na aatomarv on 11.
 Teadmised elektronkestade ja energiataseme kohta. Esimesel elektronkoorel on ainult s energiatase, teisel elektronkestal on nii s kui ka p energiatase. Kolmandal elektronkihil on s, p ja d energiatase. Neljandal elektronkihil on s, p, d ja f energiatase. Elektroneid on rohkem kui neli, kuid keskkooli keemias kohtate üldjuhul ainult nelja esimest.
Teadmised elektronkestade ja energiataseme kohta. Esimesel elektronkoorel on ainult s energiatase, teisel elektronkestal on nii s kui ka p energiatase. Kolmandal elektronkihil on s, p ja d energiatase. Neljandal elektronkihil on s, p, d ja f energiatase. Elektroneid on rohkem kui neli, kuid keskkooli keemias kohtate üldjuhul ainult nelja esimest. - Iga energiatase võib sisaldada kuni 2 elektroni.
- Iga p energiatase võib sisaldada kuni 6 elektroni.
- Iga d energiatase võib sisaldada kuni 10 elektroni.
- Iga f energiatase võib sisaldada kuni 14 elektroni.
 Tutvuge elektronide täitmise reeglitega. Vastavalt Aufbau põhimõttele peate enne elektroni lisamist kõrgemale energiatasemele lisama elektrone madalaimale energiatasemele. Igal energiatasandil võib olla mitu suborbitaali, kuid iga suborbitaal mahutab korraga kuni kaks elektroni. S energiatasemel on üks suborbitaal, p-l on 3 suborbitaali, d-l on 5 suborbitaali ja f-l on 7 suborbitaali.
Tutvuge elektronide täitmise reeglitega. Vastavalt Aufbau põhimõttele peate enne elektroni lisamist kõrgemale energiatasemele lisama elektrone madalaimale energiatasemele. Igal energiatasandil võib olla mitu suborbitaali, kuid iga suborbitaal mahutab korraga kuni kaks elektroni. S energiatasemel on üks suborbitaal, p-l on 3 suborbitaali, d-l on 5 suborbitaali ja f-l on 7 suborbitaali. - D energiatase on veidi kõrgema energiaga kui madalama elektronkesta energiatase, seega suurema s energiatase täitub suurema tõenäosusega kui madalam d energiatase. Elektronkonfiguratsiooni kirjutamiseks tähendab see, et see näeb välja selline: 1s2s2p3s3p4s3d.
 Elektroonikonfiguratsioonide kirjutamiseks kasutage diagonaalset konfiguratsioonigraafikut. Lihtsaim viis elektronide täitumise meelespidamiseks on kasutada konfiguratsiooniskeemi. Selles kirjutate üles kõik kestad ja energiatasemed. Joonistage diagonaaljooned iga rea ülemisest paremast vasakule allserva. Konfiguratsiooniskeem on järgmine:
Elektroonikonfiguratsioonide kirjutamiseks kasutage diagonaalset konfiguratsioonigraafikut. Lihtsaim viis elektronide täitumise meelespidamiseks on kasutada konfiguratsiooniskeemi. Selles kirjutate üles kõik kestad ja energiatasemed. Joonistage diagonaaljooned iga rea ülemisest paremast vasakule allserva. Konfiguratsiooniskeem on järgmine: - 1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p - Näiteks: Naatriumi elektronkonfiguratsioon (11 elektroni) on: 1s2s2p3s.
- 1s
 Määrake iga konfiguratsiooni viimane orbiit. Perioodilisustabelit vaadates saate kindlaks teha, milline saab olema elektronkonfiguratsiooni viimane alamkest ja viimane energiatase. Kõigepealt tehke kindlaks, millisesse plokki element langeb (s, p, d või f). Seejärel loendage, millises reas element asub. Lõpuks loendage, millises veerus element asub.
Määrake iga konfiguratsiooni viimane orbiit. Perioodilisustabelit vaadates saate kindlaks teha, milline saab olema elektronkonfiguratsiooni viimane alamkest ja viimane energiatase. Kõigepealt tehke kindlaks, millisesse plokki element langeb (s, p, d või f). Seejärel loendage, millises reas element asub. Lõpuks loendage, millises veerus element asub. - Näiteks on naatrium s-plokis, seega on selle elektronkonfiguratsiooni viimane orbitaal s. See asub kolmandas reas ja esimeses veerus, nii et viimane orbiit on 3s. See on hea viis oma lõpliku vastuse kontrollimiseks.
- Reegel on orbitaali d jaoks veidi erinev. D-ploki elementide esimene rida algab neljandast reast, kuid rea numbrist peate lahutama 1, kuna s-tasemetel on madalam energia kui d-tasemetel. Näiteks: vanaadium lõpeb 3d-ga.
- Teine võimalus oma tööd kontrollida on kõigi ülaindeksite liitmine. Need peavad olema võrdsed elemendi elektronide arvuga. Kui teil on liiga vähe või liiga palju elektrone, peaksite oma töö ümber mõtlema ja proovima uuesti.
2. osa 2: väärisgaasi elektronide konfiguratsioon
 Määrake väärisgaasi elektronide konfiguratsioon. Väärisgaasi elektronide konfiguratsioon on omamoodi lühike viis, kuidas kirjutada välja elemendi täielik elektronkonfiguratsioon. Väärtusgaaside kiirlahendust kasutatakse elemendi elektronkonfiguratsiooni kokkuvõtmiseks, pakkudes samal ajal kõige olulisemat teavet selle elemendi valentselektronide kohta.
Määrake väärisgaasi elektronide konfiguratsioon. Väärisgaasi elektronide konfiguratsioon on omamoodi lühike viis, kuidas kirjutada välja elemendi täielik elektronkonfiguratsioon. Väärtusgaaside kiirlahendust kasutatakse elemendi elektronkonfiguratsiooni kokkuvõtmiseks, pakkudes samal ajal kõige olulisemat teavet selle elemendi valentselektronide kohta. - Väärgaas asendatakse kõigi elektronide tähistamiseks, mis ei ole valentselektronid.
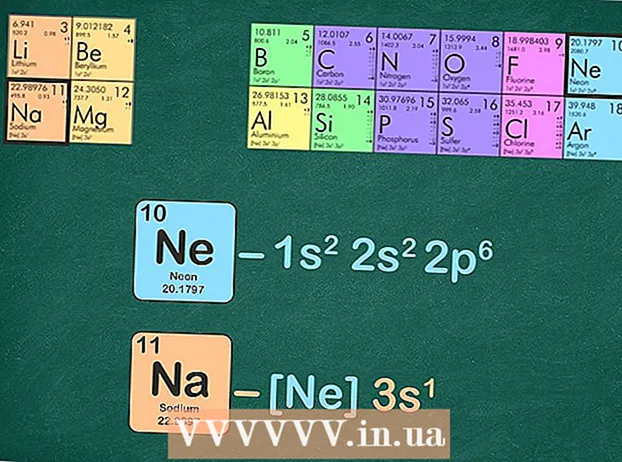
- Väärisgaasid on heelium, neoon, argoon, krüpton, ksenoon ja radoon ning need paiknevad perioodilisustabeli viimases veerus.
 Määrake oma elemendi ajavahemikul väärisgaas. Elemendi periood on horisontaalne rida, milles element asub. Kui element asub perioodilisustabeli neljandas reas, on see perioodil neli. Teie kasutatav väärisgaas on kolmandal perioodil. Allpool on loetelu väärisgaasidest ja nende perioodidest:
Määrake oma elemendi ajavahemikul väärisgaas. Elemendi periood on horisontaalne rida, milles element asub. Kui element asub perioodilisustabeli neljandas reas, on see perioodil neli. Teie kasutatav väärisgaas on kolmandal perioodil. Allpool on loetelu väärisgaasidest ja nende perioodidest: - 1: heelium
- 2: Neoon
- 3: argoon
- 4: krüpton
- 5: ksenoon
- 6: radoon
- Näiteks on naatrium perioodil 3. Väärtusgaasi konfiguratsiooniks kasutame neooni, kuna see on 2. perioodil.
 Asendage väärisgaas sama arvu elektronidega, mis väärisgaasil on. Selle järgmise sammu tegemiseks on mõned võimalused. Võite välja kirjutada väärisgaasi elektronkonfiguratsiooni ja seejärel asendada see sama konfiguratsioon huvipakkuvas elemendis. Alternatiiviks on sama arvu elektronide eemaldamine, mis väärisgaasil on, elemendist, mille konfiguratsiooni kirjutate.
Asendage väärisgaas sama arvu elektronidega, mis väärisgaasil on. Selle järgmise sammu tegemiseks on mõned võimalused. Võite välja kirjutada väärisgaasi elektronkonfiguratsiooni ja seejärel asendada see sama konfiguratsioon huvipakkuvas elemendis. Alternatiiviks on sama arvu elektronide eemaldamine, mis väärisgaasil on, elemendist, mille konfiguratsiooni kirjutate. - Näiteks naatriumis on 11 ja neoonis 10 elektroni.
- Naatriumi täielik elektronkonfiguratsioon on: 1s22p3 ja neoon on 1s22p. Nagu näete, on naatriumil 3-sid, mida neoonil pole - sellepärast saab naatriumi väärisgaaside konfiguratsioonist [Ne] 3.
- Teise võimalusena võite lugeda energiatasemete ülaindekseid, kuni teil on kümme. Eemaldage need energiatasemed ja rääkimata sellest, mis järele jääb. Kui kasutate naatriumi elektronkonfiguratsiooni kirjutamiseks neooni, jääb teile üks elektron: [Ne] 3.
Hoiatused
- Ainult neutraalses aatomis on aatomnumber võrdne elektronide arvuga. Ioon sisaldab erinevat arvu elektrone. Kui iooni laeng on -1, on sellel üks lisaelektron. Laengul -2 on kaks lisaelektroni jne.