Autor:
Florence Bailey
Loomise Kuupäev:
21 Märts 2021
Värskenduse Kuupäev:
1 Juuli 2024
Sisu
- Sammud
- Meetod 1: 2: elektronide jaotus D. I. Mendelejevi perioodilise süsteemi abil
- Meetod 2/2: ADOMAH perioodilise tabeli kasutamine
- Näpunäiteid
Elektrooniline konfiguratsioon aatom on elektronide orbitaalide arvuline esitus. Elektroonilised orbitaalid on aatomituuma ümber paiknevad erineva kujuga piirkonnad, milles elektron on matemaatiliselt tõenäoline. Elektrooniline konfiguratsioon aitab kiiresti ja hõlpsalt lugejale öelda, kui palju elektronide orbitaale aatomil on, samuti määrata kindlaks elektronide arv igal orbitaalil. Pärast selle artikli lugemist olete õppinud elektrooniliste konfiguratsioonide genereerimise meetodi.
Sammud
Meetod 1: 2: elektronide jaotus D. I. Mendelejevi perioodilise süsteemi abil
 1 Leidke oma aatomi aatomnumber. Iga aatomiga on seotud teatud arv elektrone. Leidke perioodilisustabelist oma aatomi sümbol. Aatomnumber on positiivne täisarv, mis algab 1 -st (vesiniku puhul) ja suureneb iga järgneva aatomi kohta ühe võrra. Aatomarv on aatomi prootonite arv ja seetõttu on see ka elektronide arv aatomis, millel on nulllaeng.
1 Leidke oma aatomi aatomnumber. Iga aatomiga on seotud teatud arv elektrone. Leidke perioodilisustabelist oma aatomi sümbol. Aatomnumber on positiivne täisarv, mis algab 1 -st (vesiniku puhul) ja suureneb iga järgneva aatomi kohta ühe võrra. Aatomarv on aatomi prootonite arv ja seetõttu on see ka elektronide arv aatomis, millel on nulllaeng. - 2 Määrake aatomi laeng. Neutraalsetel aatomitel on sama arv elektrone, nagu on näidatud perioodilises tabelis. Kuid laetud aatomitel on olenevalt nende laengu mahust rohkem või vähem elektrone. Kui töötate laetud aatomiga, lisage või lahutage elektronid järgmiselt: lisage üks elektron iga negatiivse laengu kohta ja lahutage üks iga positiivse laengu kohta.
- Näiteks naatriumiaatomil, mille laeng on -1, on täiendav elektron lisaks oma aatomnumbrile 11. Teisisõnu, kogu aatomil on 12 elektroni.
- Kui me räägime naatriumiaatomist, mille laeng on +1, tuleb üks elektron lahutada aatomnumbrist 11. Seega on aatomil 10 elektroni.
- 3 Pidage meeles orbitaalide põhiloendit. Elektronide arvu kasvades täidavad need kindla järjestuse järgi aatomi elektronkesta erinevaid alamtasemeid. Iga elektronkihi alamtase, kui see on täidetud, sisaldab paarisarvulisi elektrone. Saadaval on järgmised alamtasemed:
- alamtase (mis tahes elektroonilises konfiguratsioonis olev number, mis asub tähe "s" ees) sisaldab ühte orbitaali ja vastavalt Pauli põhimõte, üks orbitaal võib sisaldada maksimaalselt 2 elektroni, seega võib elektronkihi igal alamtasemel olla 2 elektroni.
- p-alamtase sisaldab 3 orbitaali ja võib seetõttu sisaldada maksimaalselt 6 elektroni.
- d-alamtase sisaldab 5 orbitaali, seega võib sellel olla kuni 10 elektroni.
- f-alamtase sisaldab 7 orbitaali, seega võib sellel olla kuni 14 elektroni.
- g-, h-, i- ja k-alamtasemed on teoreetilised. Nendel orbitaalidel elektrone sisaldavad aatomid pole teada. G-alamtase sisaldab 9 orbitaali, nii et teoreetiliselt võiks sellel olla 18 elektroni. H-alamtasemel võib olla 11 orbitaali ja maksimaalselt 22 elektroni; i -tasemel -13 orbitaalil ja maksimaalselt 26 elektroni; k -alamtasemel - 15 orbitaali ja maksimaalselt 30 elektroni.
- Jäta orbitaalide järjekord meelde mnemoonilise triki abil:
Sober Phüsistid Dei ole Find Giraffes Hiding Minan Kitšenlased (kained füüsikud ei leia kaelkirjakuid köögis peidus).
- 4 Saate aru elektroonilisest konfiguratsioonikirjest. Elektroonilised konfiguratsioonid registreeritakse nii, et need peegeldaksid selgelt iga orbitaali elektronide arvu. Orbitaalid kirjutatakse järjestikku, kusjuures aatomite arv igal orbitaalil on ülaindeks, mis asub orbiidi nimest paremal. Valmis elektrooniline konfiguratsioon on alamtaseme tähistuste ja ülaindeksite jada.
- Näiteks lihtsaim elektrooniline konfiguratsioon: 1s 2s 2p. See konfiguratsioon näitab, et 1s alamtasemel on kaks elektroni, 2s alamtasemel kaks elektroni ja 2p alamtasemel kuus elektroni. 2 + 2 + 6 = kokku 10 elektroni. See on neutraalse neooniaatomi elektrooniline konfiguratsioon (neoonide aatomnumber on 10).
- 5 Pidage meeles orbitaalide järjekorda. Pidage meeles, et elektronide orbitaalid on nummerdatud elektronkesta arvu kasvavas järjekorras, kuid energia kasvavas järjekorras. Näiteks täidetud 4s orbitaal on vähem energiline (või vähem liikuv) kui osaliselt täidetud või täidetud 3d, seega registreeritakse kõigepealt 4s orbitaal. Kui teate orbitaalide järjekorda, saate need hõlpsalt täita vastavalt aatomi elektronide arvule. Orbitaalide täitmise järjekord on järgmine: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Aatomi elektrooniline konfiguratsioon, milles kõik orbitaalid on täidetud, on järgmine: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Pange tähele, et kui kõik orbitaalid on täidetud, on ülaltoodud kirje elemendi Uuo (ununoctium) 118 elektrooniline konfiguratsioon, mis on perioodilisustabeli kõrgeim nummerdatud aatom. Seetõttu sisaldab see elektrooniline konfiguratsioon kõiki praegu teadaolevaid neutraalse laenguga aatomi elektroonilisi alamtasemeid.
- 6 Täitke orbitaalid vastavalt oma aatomi elektronide arvule. Näiteks kui tahame kirja panna neutraalse kaltsiumi aatomi elektroonilise konfiguratsiooni, peame alustama selle aatomnumbri otsimisega perioodilisustabelist. Selle aatomnumber on 20, seega kirjutame 20 elektroniga aatomi konfiguratsiooni vastavalt ülaltoodud järjekorrale.
- Täitke orbitaalid ülaltoodud järjekorras, kuni jõuate kahekümnenda elektronini. Esimene 1s orbitaal sisaldab kahte elektroni, 2s orbitaalil on ka kaks, 2p - kuus, 3s - kaks, 3p - 6 ja 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) teisisõnu, kaltsiumi elektrooniline konfiguratsioon on järgmine: 1s 2s 2p 3s 3p 4s.
- Pange tähele, et orbitaalid on energia kasvavas järjekorras. Näiteks kui olete valmis liikuma 4. energiatasemele, siis pange kõigepealt kirja 4s orbitaal ja siis 3d. Pärast neljandat energiataset lähete viiendale, kus kordub sama järjekord. See juhtub alles pärast kolmandat energiataset.
- 7 Kasutage perioodilist tabelit visuaalse vihjena. Olete ilmselt juba märganud, et perioodilise tabeli kuju vastab elektrooniliste alamtasemete järjekorrale elektroonilistes konfiguratsioonides. Näiteks vasakpoolses teises veerus olevad aatomid lõpevad alati tähega "s", õhukese keskmise sektsiooni paremas servas olevad aatomid aga alati tähega "d" jne. Kasutage perioodilist tabelit visuaalse juhendina konfiguratsioonide kirjutamiseks - kuna orbitaalidele lisamise järjekord vastab teie positsioonile tabelis. Vaata allpool:
- Eelkõige sisaldavad kaks vasakpoolset veergu aatomeid, mille elektroonilised konfiguratsioonid lõpevad s-orbitaalidega, tabeli parempoolne plokk sisaldab aatomeid, mille konfiguratsioon lõpeb p-orbitaalidega, ja alumises osas aatomid lõpevad f-orbitaalidega.
- Näiteks kui kirjutate üles kloori elektroonilise konfiguratsiooni, mõelge nii: "See aatom asub perioodilise tabeli kolmandal real (või" perioodil "). See asub ka p -orbitaalploki viiendas rühmas Seetõttu lõpeb selle elektrooniline konfiguratsioon tähtajaga ..3p
- Pange tähele: tabeli d ja f orbitaalide piirkonna elemente iseloomustavad energiatasemed, mis ei vasta perioodile, mil need asuvad. Näiteks d-orbitaalidega elementide ploki esimene rida vastab 3d orbitaalidele, kuigi see asub neljandal perioodil, ja f-orbitaalidega elementide esimene rida vastab orbiidile 4f, hoolimata asjaolust, et see on kuuendal perioodil.
- 8 Õppige lühikirjeldust pikkade elektrooniliste konfiguratsioonide kirjutamiseks. Periooditabeli paremas servas olevaid aatomeid nimetatakse väärisgaasid. Need elemendid on keemiliselt väga stabiilsed. Pikkade elektrooniliste konfiguratsioonide kirjutamise protsessi lühendamiseks kirjutage lihtsalt nurksulgudesse lähima väärisgaasi keemiline sümbol, milles on vähem elektrone kui teie aatom, ja jätkake järgmiste orbitaaltasandite elektroonilise konfiguratsiooni kirjutamist. Vaata allpool:
- Selle kontseptsiooni mõistmiseks on kasulik kirjutada näite konfiguratsioon. Kirjutame tsingi (aatomnumber 30) konfiguratsiooni, kasutades väärisgaasi lühendit. Tsingi täielik konfiguratsioon näeb välja selline: 1s 2s 2p 3s 3p 4s 3d. Siiski näeme, et 1s 2s 2p 3s 3p on argooni, väärisgaasi elektrooniline konfiguratsioon. Lihtsalt asendage tsingi elektrooniline konfiguratsiooniosa nurksulgudes oleva keemilise sümboli argooniga ([Ar]).
- Tsingi elektrooniline konfiguratsioon, mis on kirjutatud lühendatud kujul, on järgmine: [Ar] 4s 3d.
- Pange tähele, et kui kirjutate väärisgaasi elektroonilist konfiguratsiooni, näiteks argooni, ei saa te kirjutada [Ar]! Tuleb kasutada väärisgaasi redutseerimist selle elemendi ees; argooni puhul on see neoon ([Ne]).
Meetod 2/2: ADOMAH perioodilise tabeli kasutamine
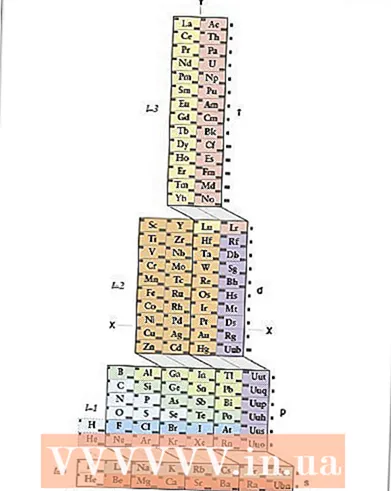
 1 Tutvuge ADOMAH perioodilise tabeliga. See elektroonilise konfiguratsiooni salvestamise meetod ei vaja meeldejätmist, kuid see nõuab korrigeeritud periooditabelit, kuna traditsioonilises perioodilises tabelis, alates neljandast perioodist, ei vasta perioodinumber elektronkihile. Leidke ADOMAH perioodiline tabel - eriline perioodilise tabeli tüüp, mille on välja töötanud teadlane Valery Zimmerman. Seda on lihtne leida Internetist lühikese otsingu abil.
1 Tutvuge ADOMAH perioodilise tabeliga. See elektroonilise konfiguratsiooni salvestamise meetod ei vaja meeldejätmist, kuid see nõuab korrigeeritud periooditabelit, kuna traditsioonilises perioodilises tabelis, alates neljandast perioodist, ei vasta perioodinumber elektronkihile. Leidke ADOMAH perioodiline tabel - eriline perioodilise tabeli tüüp, mille on välja töötanud teadlane Valery Zimmerman. Seda on lihtne leida Internetist lühikese otsingu abil. - ADOMAH perioodilisustabelis tähistavad horisontaalsed read selliseid elementide rühmi nagu halogeenid, väärisgaasid, leelismetallid, leelismuldmetallid jne. Vertikaalsed veerud vastavad elektroonilistele tasanditele ja nn "kaskaadid" (plokid s, p, d ja f ühendavad diagonaaljooned) vastavad perioodidele.
- Heelium viiakse vesinikku, kuna mõlemal elemendil on 1s orbitaal. Perioodiplokid (s, p, d ja f) on näidatud paremal ja taseme numbrid all. Elemendid on näidatud kastides numbritega 1 kuni 120. Need numbrid on tavalised aatomnumbrid, mis esindavad neutraalse aatomi elektronide koguarvu.
- 2 Leidke oma aatom ADOMAH tabelist. Elemendi elektroonilise konfiguratsiooni salvestamiseks leidke selle sümbol ADOMAH perioodilisest tabelist ja kriipsutage läbi kõik kõrgema aatomnumbriga elemendid. Näiteks kui teil on vaja erbiumi (68) elektrooniline konfiguratsioon kirja panna, kriipsutage kõik elemendid vahemikku 69 kuni 120.
- Pange tähele tabeli allosas olevaid numbreid 1 kuni 8. Need on elektroonilised taseme numbrid või veerunumbrid. Ignoreerige veerge, mis sisaldavad ainult läbi kriipsutatud üksusi.Erbiumi puhul jäävad veerud numbritega 1, 2, 3, 4, 5 ja 6 alles.
- 3 Lugege orbiidi alamtasemed oma elemendini. Vaadates tabelis paremal näidatud plokksümbolid (s, p, d ja f) ja veerunumbreid, mis on näidatud allosas, ignoreerige plokkide vahelisi diagonaaljooni ja jagage veerud veeruplokkideks altpoolt tippu. Jällegi ignoreerige kaste, kus kõik elemendid on läbi kriipsutatud. Kirjutage veeruplokid üles, alustades veeru numbrist, millele järgneb ploki sümbol, nii: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (erbiumi puhul).
- Märkus. Ülaltoodud elektrooniline konfiguratsioon Er on kirjutatud elektroonilise alamastme numbri kasvavas järjekorras. Seda saab kirjutada ka orbitaalide täitmise järjekorras. Selleks järgige veeruplokkide kirjutamisel kaskaade alt üles, mitte veerge: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Loendage elektronid iga elektroonilise alamtaseme jaoks. Loendage iga plokkveeru elemendid, mis ei olnud läbi kriipsutatud, lisades igast elemendist ühe elektroni ja kirjutage nende arv iga plokkveeru jaoks plokksümboli juurde järgmiselt: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... Meie näites on see erbiumi elektrooniline konfiguratsioon.
- 5 Mõelge valedele elektroonilistele konfiguratsioonidele. Madalaima energiatasemega aatomite elektrooniliste konfiguratsioonidega, mida nimetatakse ka põhienergia olekuteks, on kaheksateist tüüpilist erandit. Nad ei allu üldreeglile ainult elektronide viimasel kahel -kolmel positsioonil. Sel juhul eeldab tegelik elektrooniline konfiguratsioon, et elektronid on aatomi standardkonfiguratsiooniga võrreldes madalama energiaga. Erandi aatomite hulka kuuluvad:
- Kr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) ja Cm (..., 5f7, 6d1, 7s2).
Näpunäiteid
- Aatomi aatomnumbri leidmiseks, kui see on kirjutatud elektroonilises konfiguratsioonis, lisage lihtsalt kõik tähed (s, p, d ja f) järgnevad numbrid. See toimib ainult neutraalsete aatomite puhul, kui tegemist on iooniga, siis midagi ei tööta - peate lisama või lahutama lisa- või kadunud elektronide arvu.
- Tähele järgnev number on ülaindeks, ärge tehke tšekis viga.
- Puudub "pooleldi täidetud" alamtaseme stabiilsus. See on lihtsustus. Igasugune stabiilsus, mis on seotud "pooleldi täidetud" alamtasemetega, on tingitud asjaolust, et iga orbitaal on hõivatud ühe elektroniga, seega on elektronide vaheline tõrjumine minimeeritud.
- Iga aatom kaldub stabiilsesse olekusse ja kõige stabiilsemad konfiguratsioonid on täitnud alamtasemed s ja p (s2 ja p6). Väärisgaasid on sellise konfiguratsiooniga, seetõttu reageerivad nad harva ja asuvad perioodilisustabelis paremal. Seega, kui konfiguratsioon lõpeb 3p juures, vajab see stabiilse oleku saavutamiseks kahte elektroni (kuue kaotamiseks, sealhulgas alamtaseme elektronid, on vaja rohkem energiat, seega on lihtsam kaotada neli). Ja kui konfiguratsioon lõpeb 4d -ga, peab see stabiilse oleku saavutamiseks kaotama kolm elektroni. Lisaks on pooltäidetud alamtasemed (s1, p3, d5 ..) stabiilsemad kui näiteks p4 või p2; s2 ja p6 on aga veelgi tugevamad.
- Kui tegemist on iooniga, tähendab see, et prootonite arv ei ole võrdne elektronide arvuga. Sel juhul kuvatakse aatomi laeng keemilise sümboli paremas ülanurgas (reeglina). Seetõttu on antimoni aatomil, mille laeng on +2, elektrooniline konfiguratsioon 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Pange tähele, et 5p on muutunud 5p -ks. Olge ettevaatlik, kui neutraalse aatomi konfiguratsioon jõuab alamtasemele peale s ja p. Elektronide ülesvõtmisel saate neid korjata ainult valentsorbitaalidelt (s ja p orbitaalid).Seega, kui konfiguratsioon lõpeb 4s 3d ja aatom saab +2 laengu, lõpeb konfiguratsioon 4s 3d. Pange tähele, et 3D mitte muutub, selle asemel, et kaotada s-orbitaalseid elektrone.
- On tingimusi, kus elektron on sunnitud "minema kõrgemale energiatasemele". Kui alamtasemel puudub üks elektron poole või täieliku täitumiseni, võtke üks elektron lähima s- või p-alamtaseme järgi ja viige see alamtasemele, mis vajab elektroni.
- Elektroonilise konfiguratsiooni salvestamiseks on kaks võimalust. Neid saab kirjutada energiataseme numbrite kasvavas järjekorras või elektronide orbitaalide täitmise järjekorras, nagu ülal näidatud erbiumi puhul.
- Samuti saate elemendi elektroonilise konfiguratsiooni üles kirjutada, kirjutades üles ainult valentskonfiguratsiooni, mis on viimased s ja alamtasemed. Seega on antimoni valentskonfiguratsioonil 5s 5p.
- Joona pole sama. Nendega on palju keerulisem. Jätke kaks taset vahele ja järgige sama mustrit sõltuvalt sellest, kust alustasite ja kui suur on elektronide arv.