Autor:
Helen Garcia
Loomise Kuupäev:
21 Aprill 2021
Värskenduse Kuupäev:
1 Juuli 2024
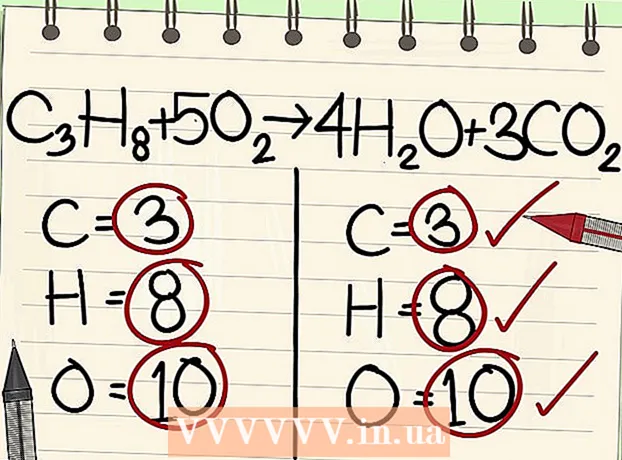
Sisu
Keemiline võrrand on keemilise reaktsiooni sümboolne esitus. Sellisel juhul kirjutatakse reageerivad ühendid (reagendid) vasakule ja saadud ained (reaktsioonisaadused) võrrandi paremale küljele. Nende vahele pannakse vasakult paremale nool, mis näitab reaktsiooni suunda. Vastavalt massi säilimise seadusele ei saa keemilise reaktsiooni käigus uusi aatomeid tekkida või vanad kaduda; seetõttu peab reagentide aatomite arv olema võrdne aatomite arvuga keemilise reaktsiooni saadustes . Selles artiklis kirjeldatakse keemiliste võrrandite tasakaalustamist erinevate meetodite abil.
Sammud
Meetod 1: 2: traditsiooniline meetod
 1 Kirjutage keemiline võrrand. Näiteks kaaluge järgmist reaktsiooni:
1 Kirjutage keemiline võrrand. Näiteks kaaluge järgmist reaktsiooni: - C3H8 + O2 -> H2O + CO2
- See reaktsioon kirjeldab propaani (C.3H8) hapniku juuresolekul vee ja süsinikdioksiidi (süsinikdioksiidi) moodustamiseks.
 2 Kirjutage iga elemendi aatomite arv üles. Tehke seda võrrandi mõlema poole jaoks. Märkige aatomite koguarvu määramiseks iga elemendi kõrval olevad alamindeksid. Kirjutage võrrandi iga elemendi sümbol üles ja märkige vastav aatomite arv.
2 Kirjutage iga elemendi aatomite arv üles. Tehke seda võrrandi mõlema poole jaoks. Märkige aatomite koguarvu määramiseks iga elemendi kõrval olevad alamindeksid. Kirjutage võrrandi iga elemendi sümbol üles ja märkige vastav aatomite arv. - Näiteks vaatlusaluse võrrandi paremal küljel saame liitmise tulemusena 3 hapnikuaatomit.
- Vasakul küljel on meil 3 süsinikuaatomit (C.3), 8 vesinikuaatomit (H8) ja 2 hapniku aatomit (O2).
- Paremal küljel on meil 1 süsinikuaatom (C), 2 vesinikuaatomit (H2) ja 3 hapnikuaatomit (O + O2).
 3 Säästke vesinik ja hapnik hilisemaks, kuna need on osa mitmest ühendist vasakul ja paremal küljel. Vesinik ja hapnik on osa mitmest molekulist, seega on kõige parem neid viimasena tasakaalustada.
3 Säästke vesinik ja hapnik hilisemaks, kuna need on osa mitmest ühendist vasakul ja paremal küljel. Vesinik ja hapnik on osa mitmest molekulist, seega on kõige parem neid viimasena tasakaalustada. - Enne vesiniku ja hapniku tasakaalustamist peate aatomid uuesti üle lugema, kuna teiste elementide tasakaalustamiseks võib vaja minna täiendavaid tegureid.
 4 Alustage kõige vähem levinud esemega. Kui teil on vaja tasakaalustada mitu elementi, valige üks, mis on osa ühest reaktiivimolekulist ja ühest reaktsioonisaaduste molekulist. Niisiis, süsinik tuleb kõigepealt tasakaalustada.
4 Alustage kõige vähem levinud esemega. Kui teil on vaja tasakaalustada mitu elementi, valige üks, mis on osa ühest reaktiivimolekulist ja ühest reaktsioonisaaduste molekulist. Niisiis, süsinik tuleb kõigepealt tasakaalustada.  5 Tasakaalu huvides lisage tegur ühe süsinikuaatomi ette. Pange üksiku süsiniku ette tegur võrrandi paremale küljele, et tasakaalustada see 3 süsinikuga vasakul küljel.
5 Tasakaalu huvides lisage tegur ühe süsinikuaatomi ette. Pange üksiku süsiniku ette tegur võrrandi paremale küljele, et tasakaalustada see 3 süsinikuga vasakul küljel. - C3H8 + O2 -> H2O + 3CO2
- Tegur 3 võrrandi paremal küljel oleva süsiniku ees näitab, et seal on kolm süsinikuaatomit, mis vastavad vasakul küljel oleva propaani molekuli kolmele süsinikuaatomile.
- Keemilises võrrandis saate koefitsiente muuta aatomite ja molekulide ees, kuid alaindeksid peavad jääma muutumatuks.
 6 Seejärel tasakaalustage vesinikuaatomid. Pärast vasaku ja parema poole süsinikuaatomite arvu võrdsustamist jäid vesinik ja hapnik tasakaalust välja. Võrrandi vasak pool sisaldab 8 vesinikuaatomit, sama arv peaks olema paremal. Saavutage see suhtega.
6 Seejärel tasakaalustage vesinikuaatomid. Pärast vasaku ja parema poole süsinikuaatomite arvu võrdsustamist jäid vesinik ja hapnik tasakaalust välja. Võrrandi vasak pool sisaldab 8 vesinikuaatomit, sama arv peaks olema paremal. Saavutage see suhtega. - C3H8 + O2 -> 4H2O + 3CO2
- Oleme paremale lisanud teguri 4, kuna alaindeks näitab, et meil on juba kaks vesinikuaatomit.
- Kui korrutada tegur 4 alamindeksiga 2, saate 8.
- Selle tulemusena saadakse paremale küljele 10 hapniku aatomit: 3x2 = 6 aatomit kolmes 3CO molekulis2 ja veel neli aatomit neljas veemolekulis.
 7 Tasakaalustage hapniku aatomid. Ärge unustage arvesse võtta koefitsiente, mida kasutasite teiste aatomite tasakaalustamiseks. Kuna lisasite koefitsiendid võrrandi paremal küljel olevate molekulide ette, muutus hapniku aatomite arv. Nüüd on teil vee molekulides 4 hapniku aatomit ja süsinikdioksiidi molekulides 6 hapniku aatomit. Seega on paremal küljel 10 hapniku aatomit.
7 Tasakaalustage hapniku aatomid. Ärge unustage arvesse võtta koefitsiente, mida kasutasite teiste aatomite tasakaalustamiseks. Kuna lisasite koefitsiendid võrrandi paremal küljel olevate molekulide ette, muutus hapniku aatomite arv. Nüüd on teil vee molekulides 4 hapniku aatomit ja süsinikdioksiidi molekulides 6 hapniku aatomit. Seega on paremal küljel 10 hapniku aatomit. - Lisage võrrandi vasakul küljel olevale hapniku molekulile tegur 5. Iga tükk sisaldab nüüd 10 hapniku aatomit.
- C3H8 + 5O2 -> 4H2O + 3CO2.

- Seega sisaldavad võrrandi mõlemad pooled sama arvu süsiniku, vesiniku ja hapniku aatomeid. Võrrand on tasakaalus.
Meetod 2/2: algebraline meetod
- 1 Kirjutage reaktsioonivõrrand üles. Näiteks kaaluge järgmist keemilist reaktsiooni:
- PCl5 + H2O -> H3PO4 + HCl
- 2 Pange iga ühenduse ette täht:
- aPCl5 + bH2O -> cH3PO4 + dHCl
- 3 Võrdsuse vasakul ja paremal küljel võrdsustage iga elemendi aatomite arv.
- aPCl5 + bH2O -> cH3PO4 + dHCl
- Vasakul on meil 2b vesinikuaatomid (2 kummaski H2O), paremal on 3c+d vesinikuaatomid (3 igas H -s3PO4 ja 1 igas HCl molekulis). Kuna vasak ja parem pool peavad sisaldama sama arvu vesinikuaatomeid, 2b peaks olema võrdne 3 -gac+d.
- Tehke seda kõigi elementide jaoks:
- P: a=c
- Cl: 5a=d
- H: 2b=3c+d
- 4 Lahendage koefitsientide arvväärtuste leidmiseks võrrandisüsteem. Süsteemil on mitmeid lahendusi, kuna muutujaid on rohkem kui võrrandeid. On vaja leida selline lahendus, et kõik koefitsiendid oleksid võimalikult väikeste täisarvude kujul.
- Võrrandisüsteemi kiireks lahendamiseks määrake ühele muutujale arvväärtus. Oletame, et a = 1. Lahendame süsteemi ja leiame ülejäänud muutujate väärtused:
- Kui P a = c, siis c = 1
- Cl 5a = d, seega d = 5
- Kuna H 2b = 3c + d jaoks leiame väärtuse b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4
- Seega on meil järgmised koefitsiendid:
- a = 1
- b = 4
- c = 1
- d = 5
Näpunäiteid
- Kui teil on raskusi, saab veebikalkulaatorit kasutada keemiliste võrrandite tasakaalustamiseks. Pange aga tähele, et sellist kalkulaatorit ei tohi eksami ajal kasutada, seega ärge lootke ainult sellele.
- Pidage meeles, et mõnikord saab võrrandit lihtsustada! Kui kõik koefitsiendid on isegi jagatud täisarvuga, lihtsustage võrrandit.
Hoiatused
- Murdkoefitsientidest vabanemiseks korrutage kogu võrrand (selle vasak ja parem külg) murdosa nimetajaga.
- Ärge kunagi kasutage murdusid keemilise võrrandi koefitsientidena - keemilistes reaktsioonides ei ole pooli molekule ega aatomeid.
- Tasakaalustamisprotsessis saate mugavuse huvides kasutada murdosi, kuid võrrand ei ole tasakaalustatud seni, kuni selles on murdkoefitsiente.



