Autor:
Lewis Jackson
Loomise Kuupäev:
8 Mai 2021
Värskenduse Kuupäev:
25 Juunis 2024

Sisu
Ioonne netovõrrand on keemia oluline osa, kuna see esindab ainult keemilises reaktsioonis muutuvaid osakesi. Neid kasutatakse kõige sagedamini oksüdatsiooni - redutseerimise, vahetuse ja happe - aluse neutraliseerimise reaktsioonides. Ioonse netovõrrandi kirjutamiseks on kolm peamist sammu: tasakaalustage molekulaarvõrrand, teisendage see täielikuks ioonvõrrandiks (kuidas iga aine lahuses eksisteerib) ja lõpuks kirjutage netoioonvõrrand.
Sammud
1. osa 2: ioonvõrrandi komponentide mõistmine
Teadke molekuli ja ioonsed ühendid. Ioonse netovõrrandi kirjutamise esimene samm on määrata reaktsioonis olevad ioonsed ühendid. Ioonsed ühendid on need, mis vesilahuses ioone lahutavad ja millel on elektrilaeng. Molekulaarsed ühendid on ühendid, millel pole kunagi elektrilaengut. Need moodustuvad kahe mittemetalli vahel ja neid nimetatakse mõnikord kovalentseteks ühenditeks.
- Ioonseid ühendeid võib moodustada metallide ja mittemetallide, metallide ja polüatoomiliste ioonide või mitme polüatoomse iooni vahel.
- Kui te pole kindel, mis ühend on, võite perioodilisustabelilt otsida selle ühendi elemente.

Tunnistage ühendi lahustuvus. Kõik ioonsed ühendid ei lahustu vesilahuses ja seetõttu ei saa nad ioonideks eralduda. Enne ülejäänud võrrandi jätkamist peate tuvastama iga ühendi lahustuvuse. Allpool on kokkuvõte lahustuvuse reeglitest. Üksikasjalikuma teabe ja nende reeglite erandite kohta leiate lahustuvustabeli.- Järgige neid reegleid allpool toodud järjekorras.
- Kõik Na, K ja NH soolad4 kõik sulavad.
- Kõik NO soolad3, C2H3O2, ClO3ja ClO4 kõik sulavad.
- Kõik Ag-, Pb- ja Hg-soolad2 kõik sulavad.
- Kõik Cl-, Br- ja I-soolad on lahustuvad.
- Kõik CO soolad3, O, S, OH, PO4, CrO4, Kr2O7, ja nii3 on lahustunud (välja arvatud mõnel juhul).
- Kõik SO soolad4 on lahustunud (välja arvatud mõnel juhul).
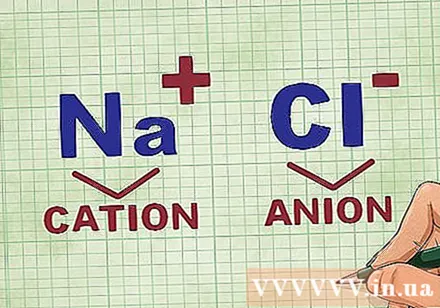
Katioonide ja anioonide määramine ühendis. Katioonid on ühendi positiivsed ioonid ja tavaliselt metall. Anioon on ühendi negatiivne ioon ja mittemetalliline. Mõned mittemetallid võivad moodustada katioone, kuid metallid moodustavad alati katioone.- Näiteks NaCl-s on Na positiivselt laetud katioon, kuna see on metall, ja Cl on negatiivselt laetud anioon, kuna see on mittemetall.

Tundke reaktsioonis ära polüatoomsed ioonid. Polüatoomilised ioonid on laetud molekulid, mis on omavahel tihedalt seotud ega lahku keemiliste reaktsioonide käigus. Polüatoomilisi ioone on oluline ära tunda, kuna neil on spetsiifiline laeng ja nad ei lahku. Polüatoomilistel ioonidel võib olla positiivne või negatiivne laeng.- Kui õpite üldkeemiat, tuleb sageli meeles pidada mõnda levinumat polüatoomilist iooni.
- Mõned levinud polüatoomsed ioonid on CO3, EI3, EI2, NII4, NII3, ClO4 ja ClO3.
- Palju muid ioone leiate ka keemiaraamatutest või Internetist.
2. osa 2-st: ioonse netovõrrandi kirjutamine
Molekulivõrrandite tasakaalustamine. Enne netoioonvõrrandi kirjutamist peate veenduma, et teie molekulaarne võrrand on tasakaalus. Võrrandi tasakaalustamiseks lisage koefitsiendid ühendi ette nii, et iga elemendi aatomnumber oleks võrrandi mõlemal küljel võrdne.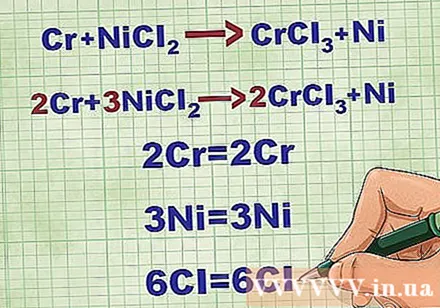
- Pange võrrandi mõlemale küljele kirja iga ühendi moodustavate aatomite arv.
- Mõlemate külgede tasakaalustamiseks lisage koefitsient muude elementide kui hapniku ja vesiniku ette.
- Vesiniku aatomi tasakaal.
- Hapniku aatomi tasakaal.
- Loendage võrrandite mõlemal küljel olevate aatomite arv, et veenduda nende tasakaalustatuses.
- Näiteks Cr + NiCl2 -> CrCl3 + Ni Tasakaalustatud väärtuseni 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Tehke võrrandis kindlaks ühendi olek. Mitu korda on probleemis märksõnu, mis annavad teada iga ühendi olekust. On mitmeid reegleid, mis aitavad määrata elemendi või ühendi olekut.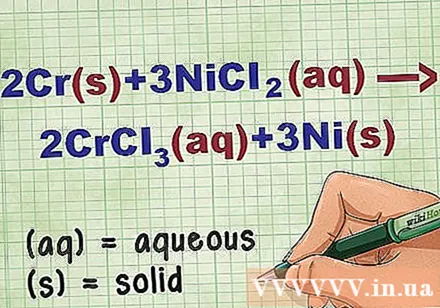
- Kui elemendi olekut ei esitata, siis kasutage perioodikatabelis leiduvat olekut.
- Kui ühendit nimetatakse lahuseks, võite selle kirjutada vesilahusena või (dd).
- Kui võrrandis on vett, peate lahustuvustabeli abil kindlaks tegema, kas ioonne ühend on vees lahustuv. Kui lahustuvus on kõrge, on see ühend vesilahus (dd), kui lahustuvus on madal, on ühend tahke (r).
- Ilma veeta on ioonne ühend tahke (r).
- Kui probleem on happeline või aluseline, siis on ühend vesilahus (dd).
- Näiteks 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Cr ja Ni elementaarvormid on tahkes olekus. NiCl2 ja CrCl3 ioonsed ühendid on lahustuvad, seega on need veepõhised. Kirjutage võrrand ümber järgmiselt: 2Cr(r) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
Määrake, millised ühendid lahuses eralduvad (dissotsieeruvad katioonideks ja anioonideks). Kui aine või ühend dissotsieerub, dissotsieerub see positiivselt laetud iooniks (katiooniks) ja negatiivselt laetud iooniks (aniooniks). Need on komponendid, mis tasakaalustuvad ioonse netovõrrandi lõpus.
- Tahked ained, vedelikud, gaasid, molekulaarsed ühendid, madala lahustuvusega ioonsed ühendid, polüatoomsed ioonid ja nõrgad happed ei eraldu.
- Ioonühenditel on kõrge lahustuvus (kasutage lahustuvustabelit) ja tugevad happed ioniseeruvad 100% (HCl(dd), HBr(dd), TERE(dd), H2NII4(dd)HClO4(dd)ja HNO3(dd)).
- Pange tähele, et kuigi polüatoomilised ioonid enam ei dissotsieeru, siis kui nad on selle ühendi koostisosad, siis dissotsieeruvad nad ühendist.
Arvutage iga ühendist dissotsieerunud iooni laeng. Pidage meeles, et metallid moodustavad positiivseid ja mittemetallid negatiivseid. Elemendi laengu määramiseks kasutage perioodilisustabelit. Samuti peate tasakaalustama iga ühendi iooni laengut.
- Selles näites NiCl2 dissotsieerus Ni ja Cl, samal ajal kui CrCl3 jagada Cr ja Cl.
- Ni laeng on 2+, kuna Cl on ühe negatiivse laenguga, kuid sellel on 2 aatomit. Seetõttu peame tasakaalustama 2 negatiivset Cl-iooni. Cr-l on 3+ laeng, seega peame tasakaalustama 3 negatiivset Cl-iooni.
- Pidage meeles, et polüatoomilistel ioonidel on spetsiifiline laeng.
Pange kirja täielik ioonvõrrand. Kõik, mis dissotsieerub või ioniseerub (tugevad happed), eraldub kaheks eraldi iooniks. Aine olek jääb püsima (dd), kuid veenduge, et võrrand oleks tasakaalus.
- Tahked ained, vedelikud, gaasid, nõrgad happed ja madala lahustuvusega ioonsed ühendid ei muuda olekut ega eraldu ioonideks. Hoiame neid puutumatuna.
- Molekulaarsed ained lahustuvad lahuses, nii et nende olek muutubdd). Kolm erandit ei ole saama (dd) on: CH4(k), C3H8(k)ja C8H18(l).
- Jätkates ülaltoodud näidet, näeb täielik ioonvõrrand välja selline: 2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(r). Kui Cl ei ole ühendis, pole see ka bipolaarne, seega korrutame koefitsiendi ühendi aatomite arvuga, et saada võrrandi mõlemale küljele 6 Cl iooni.
Eemaldage tasakaaluioonid, tühistades võrrandi mõlemal küljel samad ioonid. Tühistada saate ainult siis, kui need on mõlemal küljel täpselt samad (laeng, aatomnumber jne). Kirjutage võrrand ümber ilma lagunevate aineteta.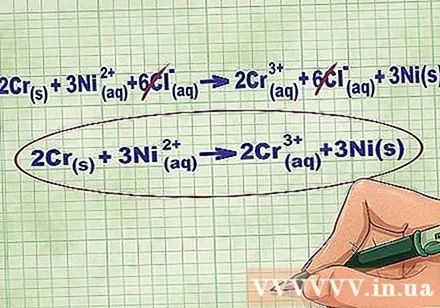
- Pärast näite lõpetamist on meil mõlemal küljel 6 tühistatavat Cl-iooni. Iooniline netovõrrand on 2Cr(r) + 3Ni(dd) -> 2Cr(dd) + 3Ni(r).
- Kui teil on õigus, peaks reaktiivi kogu laeng olema võrdne ioonväärtuse võrrandi toote poolse laenguga.
Nõuanne
- Kirjutage võrrandisse kõigi ainete olekud, kui mitte teie tahe kaotada punkte.



