Autor:
Monica Porter
Loomise Kuupäev:
22 Märts 2021
Värskenduse Kuupäev:
1 Juuli 2024
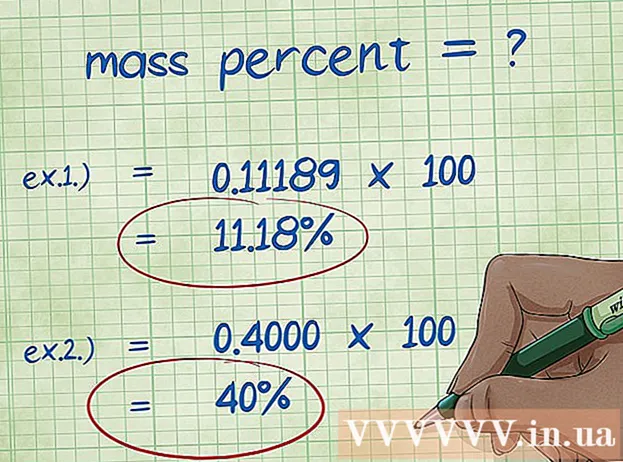
Sisu
Massiprotsent näitab iga elemendi protsenti keemilises ühendis. Massiprotsentide leidmiseks tuleb teada ühendi elementide molaarmass grammides / mol või lahuse moodustavate ainete grammide arv. Massiprotsent arvutatakse lihtsa valemi abil, mis jagab elemendi (või soluudi) massi ühendi (või lahuse) massiga.
Sammud
1. meetod 2-st: arvutage massiprotsent teades massi
Määrake segu massiprotsendi võrrand. Segumassi massiprotsendi arvutamise põhivalem on: massiprotsent = (kvaliteedimass / segamass) x 100. Lõpuks tuleb protsendi näitamiseks korrutada 100-ga.
- Kirjutage probleemi lahendamise alustamisel võrrand: massiprotsent = (aine mass / segamass) x 100.
- Kvaliteedi hulk antakse ülesandes. Kui teemat ei esitata, vaadake järgmist jaotist, kuidas leida massiprotsente mahu tundmata.
- Segu mass on võrdne segu või lahuse moodustavate ainete kogumassiga.

Arvutage segu mass. Kui olete teadnud elementide või ühendite massid, peate lõpliku segu või lahuse massi saamiseks lisama need ainult kokku. See on nimetaja massiprotsendi valemis.- Näide 1: Kui suur on 5 g naatriumhüdroksiidi massiprotsent 100 g vees lahustatuna?
- Segu mass on naatriumhüdroksiidi ja vee kogumass: 100g + 5g. Nii et segakaal on 105g.
- Näide 2: Kui suur on naatriumkloriidi ja vee mass, et moodustada 175 g 15% lahust?
- Selles näites, kus on teada segatud mass ja massiprotsent, palutakse ülesandel leida lisatud lahustunud aine kogus. Segu mass on 175 g.
- Näide 1: Kui suur on 5 g naatriumhüdroksiidi massiprotsent 100 g vees lahustatuna?

Massiprotsendi leidmiseks määrake aine mass. Kui viktoriin palub leida aine "massiprotsent", peate leidma aine massi protsendina kõigi koostisosade kogumassist. Massiprotsendi leidmiseks kirjutage üles aine mass. See on massiprotsendi valemi lugeja.- Näide 1: Naatriumhüdroksiidi (aine, mis leitakse massifraktsioonides) mass on 5 g.
- Näide 2: Selles näites otsib aine kogus tundmatu massi protsenti ja te otsite seda.

Asendage muutujad massiprotsentide võrrandiga. Kui olete määranud iga muutuja väärtuse, ühendage need lihtsalt võrrandiga.- Näide 1: massiprotsent = (aine mass / segatud mass) x 100 = (5 g / 105 g) x 100.
- Näide 2: Tundmatu kvaliteediga koguse arvutamiseks peame teisendama massiprotsendi võrrandi: kvaliteedi mass = (massiprotsent * segatud mass) / 100 = (15 * 175) / 100 .
Arvutage mahu protsent. Nüüd, kui võrrand on täidetud, peate arvutama ainult massiprotsendi. Jagage aine mass segu massiga ja korrutage see 100-ga. See on aine massiprotsent segus.
- Näide 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Seetõttu on 100 g vees lahustatud 5 g naatriumhüdroksiidi massiprotsent 4761%.
- Näide 2: võrrand pärast teisendamist kvaliteedi koguse arvutamiseks on (massiprotsent * segamass) / 100: (15 * 175) / 100 = (2625) / 100 = 26,25 grammi naatriumkloriid.
- Lisatud vee mass on segu mass, millest lahutatakse aine kaal: 175 - 26,25 = 148,75 grammi vett.
2. meetod 2-st: arvutage massiprotsent, kui mass ei ole teada
Määrake ühendi massiprotsendi võrrand. Põhivalem ühendi massiprotsendi arvutamiseks on: massiprotsent = (elemendi molaarmass / ühendi molaarmass) x 100. Elementmolaarmass on ühe mooli elemendi mass. samas kui molekulmass on ühe mooli ühendi mass. Lõpuks peate protsentväärtuse saamiseks korrutama 100-ga.
- Kirjutage probleemi lahendamise alustamisel võrrand: massiprotsent = (elementmolaarmass / ühendi molaarmass) x 100.
- Kahe ülaltoodud väärtuse ühikud on grammid mooli kohta (g / mol).
- Kui probleem ei anna massi, võite molaarmassiga arvutada elemendi massiprotsendi.
- Näide 1: Arvutage vesiniku massiprotsent veemolekulis.
- Näide 2: Arvutage süsiniku massiprotsent glükoosimolekulis.
Kirjutage Keemiline valem. Kui probleem ei hõlma iga ühendi keemilisi valemeid, peate need üles kirjutama. Kui probleem seisneb keemilises valemis, jätke see samm vahele ja minge sammu "Leia iga elemendi mass".
- Näide 1: kirjutage vee keemiline valem H2O.
- Näide 2: kirjutage glükoosi keemiline valem C6H12O6.
Leidke ühendi iga elemendi mass. Otsige perioodilise tabeli keemilise valemi iga elemendi molekulmassi. Elementmass kirjutatakse tavaliselt keemilise sümboli alla. Pange kirja iga ühendi elemendi mass.
- Näide 1: Leiame, et hapniku massiaatom on 15,9994; ja vesiniku kuupmeetri aatom on 1,0079.
- Näide 2: Leidsime, et süsiniku massi aatom on 12 0107; hapnik on 15,9994; ja vesinik on 1,0079.
Korrutage kuupmeetri aatom molaarsuhtega. Määrake keemilise ühendi iga elemendi moolide arv (molaarsuhe). Molaarsuhe arvutatakse ühendi keemilises valemis allpool oleva väikese arvuga. Korrutage iga elemendi kuupiaatom molaarsuhtega.
- Näide 1: Vesinikul on kaks alaindeksit, hapnikul aga 1. Korrutage vesiniku molekulmass 2-ga, 1,00794 X2 = 2,01588; ja hapniku molekulmass on 15 9994 (korrutatud ühega).
- Näide 2: Süsiniku alaindeks on 6, vesinik on 12 ja hapnik on 6. Korrutage iga elemendi kuupiaatom allpool toodud indeksiga.
- Süsinik (12,0107 * 6) = 72,0642
- Vesinik (1,00794 * 12) = 12,09528
- Hapnik (15,9994 * 6) = 95,9964
Arvutage ühendi kogumass. Lisage ühendis kõigi elementide massid. Ühendite kogumassi saate arvutada molaarsuhetes väljendatud masside abil. See number on nimetaja massiprotsendi võrrandis.
- Näide 1: lisage 159994 g / mol (ühe mooli hapniku aatomi mass) 2 01588 g / mol (kahe mooli vesinikuaatomite mass) 18,01528 g / mol.
- Näide 2: lisage kõik kaalud kokku: süsinik + vesinik + hapnik = 72,0642 + 12,09528 + 95,9964 = 180,156 g / mol.
Määrake elementmass, millele massiprotsent arvutatakse. Kui probleem küsib "massiprotsenti", tähendab see, et peate ühendist leidma konkreetse elemendi massi protsendina kõigi elementide kogumassist. Määrake ja kirjutage üles elemendi mass. See mass on mass, väljendatuna molaarsuhtes. See number on massiprotsendi võrrandi lugeja.
- Näide 1: vesiniku mass ühendis on 2 01588 g / mol (kahe mooli vesinikuaatomite mass).
- Näide 2: Süsiniku mass ühendis on 72,0642 g / mol (kuue mooli süsinikuaatomite mass).
Asendage muutujad massiprotsentide võrrandiga. Pärast iga muutuja väärtuste määramist asendage need lihtsalt esimeses etapis määratletud võrrandiga: massiprotsent = (elementmolaarmass / ühendi molaarmass) x 100 .
- Näide 1: massiprotsent = (elementmolaarmass / ühendi molaarmass) x 100 = (2,1588 / 18,1528) x 100.
- Näide 2: massiprotsent = (elementmolaarmass / ühendi molaarmass) x 100 = (72,0642 / 180,156) x 100.
Arvutage mahu protsent. Nüüd, kui võrrand on täidetud, peate arvutama ainult massiprotsendi. Jagage elemendi mass ühendi kogumassiga ja korrutage see 100-ga. See on protsent ühendi elemendi massist.
- Näide 1: massiprotsent = (2,01588 / 18,01528) x 100 = 0,1111189 x 100 = 11,18%. Seetõttu on vesiniku aatomi massiprotsent veemolekulis 11,18%.
- Näide 2: massiprotsent = (elementmolaarmass / ühendi molaarmass) x 100 = (72,0642 / 180,156) x 100 = 0,4000 x 100 = 40,00%. Niisiis on süsinikuaatomi massiprotsent glükoosimolekulis 40,00%.