Autor:
Sara Rhodes
Loomise Kuupäev:
12 Veebruar 2021
Värskenduse Kuupäev:
1 Juuli 2024
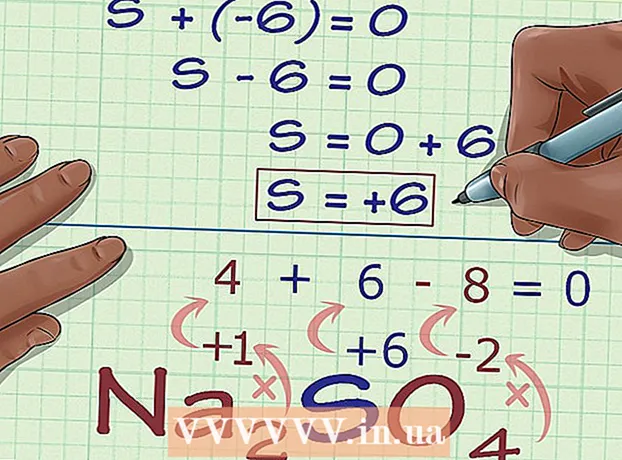
Sisu
- Sammud
- Osa 1 /2: Oksüdeerumisastme määramine vastavalt keemiaseadustele
- Osa 2 /2: Oksüdatsiooniastme määramine ilma keemiaseadusi kasutamata
- Näpunäiteid
- Mida sul vaja on
Keemias tähendavad terminid "oksüdeerumine" ja "redutseerimine" reaktsioone, mille käigus aatom või aatomite rühm kaotab või vastavalt saab elektrone. Oksüdatsiooniaste on ühele või mitmele aatomile omistatud arvväärtus, mis iseloomustab ümberjaotatud elektronide arvu ja näitab, kuidas need elektronid reaktsiooni ajal aatomite vahel jaotuvad. Selle väärtuse määramine võib olla nii lihtne kui ka üsna keeruline protseduur, sõltuvalt aatomitest ja neist koosnevatest molekulidest. Veelgi enam, mõnede elementide aatomitel võib olla mitu oksüdatsiooniastet. Õnneks on oksüdatsiooni oleku määramiseks lihtsad üheselt mõistetavad reeglid, mille enesekindlaks kasutamiseks piisab keemia ja algebra põhitõdede tundmisest.
Sammud
Osa 1 /2: Oksüdeerumisastme määramine vastavalt keemiaseadustele
 1 Tehke kindlaks, kas kõnealune aine on elementaarne. Aatomite oksüdatsiooniaste väljaspool keemilist ühendit on null. See reegel kehtib nii ainete kohta, mis on moodustatud eraldi vabadest aatomitest, kui ka ainete puhul, mis koosnevad kahest või ühe elemendi mitmeaatomilisest molekulist.
1 Tehke kindlaks, kas kõnealune aine on elementaarne. Aatomite oksüdatsiooniaste väljaspool keemilist ühendit on null. See reegel kehtib nii ainete kohta, mis on moodustatud eraldi vabadest aatomitest, kui ka ainete puhul, mis koosnevad kahest või ühe elemendi mitmeaatomilisest molekulist. - Näiteks Al(s) ja Cl2 oksüdatsiooniaste on 0, kuna mõlemad on keemiliselt sidumata elementaarses olekus.
- Pange tähele, et väävli S allotroopne vorm8või kaheksajalgseid, vaatamata ebatüüpilisele struktuurile, iseloomustab ka null oksüdatsiooniaste.
 2 Tehke kindlaks, kas kõnealune aine koosneb ioonidest. Ioonide oksüdatsiooniaste on võrdne nende laenguga. See kehtib nii vabade ioonide kui ka keemiliste ühendite osade kohta.
2 Tehke kindlaks, kas kõnealune aine koosneb ioonidest. Ioonide oksüdatsiooniaste on võrdne nende laenguga. See kehtib nii vabade ioonide kui ka keemiliste ühendite osade kohta. - Näiteks Cl iooni oksüdatsiooniaste on -1.
- Cl -iooni oksüdatsiooni olek keemilises ühendis NaCl on samuti -1. Kuna Na -ioonil on definitsiooni järgi laeng +1, järeldame, et Cl -iooni laeng on -1 ja seega on selle oksüdatsiooniaste -1.
 3 Pange tähele, et metalliioonidel võib olla mitu oksüdatsiooniastet. Paljude metallielementide aatomid võivad ioniseerida erinevates kogustes. Näiteks metalli, näiteks raua (Fe) ioonlaeng on +2 või +3. Metalliioonide laeng (ja nende oksüdatsiooniaste) saab määrata teiste elementide ioonide laengutega, millega see metall on osa keemilisest ühendist; tekstis tähistatakse seda laengut rooma numbritega: näiteks raua (III) oksüdatsiooniaste on +3.
3 Pange tähele, et metalliioonidel võib olla mitu oksüdatsiooniastet. Paljude metallielementide aatomid võivad ioniseerida erinevates kogustes. Näiteks metalli, näiteks raua (Fe) ioonlaeng on +2 või +3. Metalliioonide laeng (ja nende oksüdatsiooniaste) saab määrata teiste elementide ioonide laengutega, millega see metall on osa keemilisest ühendist; tekstis tähistatakse seda laengut rooma numbritega: näiteks raua (III) oksüdatsiooniaste on +3. - Näiteks kaaluge ühendit, mis sisaldab alumiiniumiooni. AlCl ühendi kogulaeng3 on null.Kuna me teame, et Cl -ioonide laeng on -1 ja ühend sisaldab 3 sellist iooni, peab kõnealuse aine üldise neutraalsuse tagamiseks olema Al -iooni laeng +3. Seega on sel juhul alumiiniumi oksüdatsiooniaste +3.
 4 Hapniku oksüdatsiooniaste on -2 (mõne erandiga). Peaaegu kõigil juhtudel on hapniku aatomite oksüdatsiooniaste -2. Sellest reeglist on mitu erandit:
4 Hapniku oksüdatsiooniaste on -2 (mõne erandiga). Peaaegu kõigil juhtudel on hapniku aatomite oksüdatsiooniaste -2. Sellest reeglist on mitu erandit: - Kui hapnik on elementaarses olekus (O2), on selle oksüdeerumisaste 0, nagu ka teiste elementaarsete ainete puhul.
- Kui hapnik on osa peroksiid, selle oksüdatsiooniaste on -1. Peroksiidid on ühendite rühm, mis sisaldab lihtsat hapniku-hapniku sidet (st peroksiidi aniooni O)2). Näiteks H koosseisus2O2 (vesinikperoksiid) hapniku laengu- ja oksüdatsiooniaste on -1.
- Fluoriga kombineerituna on hapniku oksüdatsiooniaste +2, lugege allpool olevat fluori reeglit.
 5 Vesiniku oksüdatsiooniaste on +1, välja arvatud mõned erandid. Nagu hapniku puhul, on ka erandeid. Reeglina on vesiniku oksüdatsiooniaste +1 (kui see ei ole elementaarses olekus H2). Hüdriidideks nimetatud ühendites on vesiniku oksüdatsiooniaste aga -1.
5 Vesiniku oksüdatsiooniaste on +1, välja arvatud mõned erandid. Nagu hapniku puhul, on ka erandeid. Reeglina on vesiniku oksüdatsiooniaste +1 (kui see ei ole elementaarses olekus H2). Hüdriidideks nimetatud ühendites on vesiniku oksüdatsiooniaste aga -1. - Näiteks H2O Vesiniku oksüdatsiooniaste on +1, kuna hapniku aatomi laeng on -2 ja üldiseks neutraalsuseks on vaja kahte +1 laengut. Sellegipoolest on naatriumhüdriidi koostises vesiniku oksüdatsiooniaste juba -1, kuna Na -ioon kannab laengut +1 ja üldise elektroneutraalsuse korral peaks vesinikuaatomi laeng (ja seega ka selle oksüdatsiooniaste) olla -1.
 6 Fluor alati oksüdatsiooniaste on -1. Nagu juba märgitud, võib mõnede elementide (metalliioonid, peroksiidides sisalduvad hapniku aatomid jne) oksüdatsiooniaste varieeruda sõltuvalt mitmest tegurist. Fluori oksüdatsiooniaste on aga alati -1. See on tingitud asjaolust, et sellel elemendil on suurim elektronegatiivsus - teisisõnu, fluori aatomid on kõige vähem valmis oma elektronidega lahutama ja meelitavad kõige aktiivsemalt võõraid elektrone. Seega jääb nende tasu muutumatuks.
6 Fluor alati oksüdatsiooniaste on -1. Nagu juba märgitud, võib mõnede elementide (metalliioonid, peroksiidides sisalduvad hapniku aatomid jne) oksüdatsiooniaste varieeruda sõltuvalt mitmest tegurist. Fluori oksüdatsiooniaste on aga alati -1. See on tingitud asjaolust, et sellel elemendil on suurim elektronegatiivsus - teisisõnu, fluori aatomid on kõige vähem valmis oma elektronidega lahutama ja meelitavad kõige aktiivsemalt võõraid elektrone. Seega jääb nende tasu muutumatuks.  7 Ühendi oksüdatsiooniastmete summa on võrdne selle laenguga. Kõigi keemiliste ühendite moodustavate aatomite oksüdatsiooniaste peaks selle ühendi laengule juurde tulema. Näiteks kui ühend on neutraalne, peaks kõigi selle aatomite oksüdatsiooniastmete summa olema null; kui ühend on polüatomiline ioon laenguga -1, on oksüdatsiooniaste summa -1 ja nii edasi.
7 Ühendi oksüdatsiooniastmete summa on võrdne selle laenguga. Kõigi keemiliste ühendite moodustavate aatomite oksüdatsiooniaste peaks selle ühendi laengule juurde tulema. Näiteks kui ühend on neutraalne, peaks kõigi selle aatomite oksüdatsiooniastmete summa olema null; kui ühend on polüatomiline ioon laenguga -1, on oksüdatsiooniaste summa -1 ja nii edasi. - See on hea katsemeetod - kui oksüdatsiooniastmete summa ei võrdu ühendi kogulaenguga, siis eksite kuskil.
Osa 2 /2: Oksüdatsiooniastme määramine ilma keemiaseadusi kasutamata
 1 Leidke aatomeid, mille oksüdatsiooni oleku kohta pole rangeid reegleid. Mõne elemendi puhul puuduvad kindlad reeglid oksüdatsiooni oleku leidmiseks. Kui aatom ei sobi ühegi eespool loetletud reegliga ja te ei tea selle laengut (näiteks aatom on kompleksi osa ja selle laengut pole täpsustatud), saate määrata sellise aatomi oksüdatsiooniastme välistamise teel. Esiteks määrake ühendi kõigi teiste aatomite laeng ja seejärel arvutage ühendi teadaoleva kogulaengu põhjal selle aatomi oksüdatsiooniaste.
1 Leidke aatomeid, mille oksüdatsiooni oleku kohta pole rangeid reegleid. Mõne elemendi puhul puuduvad kindlad reeglid oksüdatsiooni oleku leidmiseks. Kui aatom ei sobi ühegi eespool loetletud reegliga ja te ei tea selle laengut (näiteks aatom on kompleksi osa ja selle laengut pole täpsustatud), saate määrata sellise aatomi oksüdatsiooniastme välistamise teel. Esiteks määrake ühendi kõigi teiste aatomite laeng ja seejärel arvutage ühendi teadaoleva kogulaengu põhjal selle aatomi oksüdatsiooniaste. - Näiteks ühendis Na2NII4 väävliaatomi (S) laeng pole teada - me teame ainult, et see pole null, kuna väävel ei ole elementaarses olekus. See ühend on hea näide oksüdeerimisoleku määramise algebralise meetodi illustreerimiseks.
 2 Leidke ühendi ülejäänud elementide oksüdatsiooniastmed. Kasutades ülalkirjeldatud reegleid, määrake ühendi ülejäänud aatomite oksüdatsiooniaste. Ärge unustage erandeid reeglist O, H jne.
2 Leidke ühendi ülejäänud elementide oksüdatsiooniastmed. Kasutades ülalkirjeldatud reegleid, määrake ühendi ülejäänud aatomite oksüdatsiooniaste. Ärge unustage erandeid reeglist O, H jne. - Na jaoks2NII4, kasutades meie reegleid, leiame, et Na iooni laeng (ja seega ka oksüdatsiooniaste) on +1 ja iga hapniku aatomi puhul -2.
 3 Korrutage aatomite arv nende oksüdatsiooniastmega. Nüüd, kui me teame kõigi aatomite oksüdatsiooniastmeid, välja arvatud üks, on vaja arvestada, et mõnede elementide aatomid võivad olla mitu. Korrutage iga elemendi aatomite arv (see on näidatud ühendi keemilises valemis alaindeksina pärast elemendi sümbolit) selle oksüdatsiooniastmega.
3 Korrutage aatomite arv nende oksüdatsiooniastmega. Nüüd, kui me teame kõigi aatomite oksüdatsiooniastmeid, välja arvatud üks, on vaja arvestada, et mõnede elementide aatomid võivad olla mitu. Korrutage iga elemendi aatomite arv (see on näidatud ühendi keemilises valemis alaindeksina pärast elemendi sümbolit) selle oksüdatsiooniastmega. - In Na2NII4 meil on 2 aatomit ja 4 aatomit. Seega korrutades 2 × +1, saame kõigi Na aatomite oksüdatsiooniaste (2) ja korrutades 4 × -2 -O (-8) aatomite oksüdatsiooniaste.
 4 Lisage varasemad tulemused. Korrutamise tulemused kokku võttes saame ühendi oksüdatsiooni oleku ilma võttes arvesse soovitud aatomi panust.
4 Lisage varasemad tulemused. Korrutamise tulemused kokku võttes saame ühendi oksüdatsiooni oleku ilma võttes arvesse soovitud aatomi panust. - Meie näites Na jaoks2NII4 lisame 2 ja -8 ning saame -6.
 5 Leia ühendi laengust tundmatu oksüdatsiooniaste. Nüüd on teil kõik andmed soovitud oksüdatsiooniastme hõlpsaks arvutamiseks. Kirjutage võrrand, mille vasakul küljel on eelmises arvutusetapis saadud arvu ja tundmatu oksüdatsiooniastme summa ning paremal pool ühendi kogulaeng. Teisisõnu, (Teadaolevate oksüdatsiooniastmete summa) + (soovitud oksüdatsiooniaste) = (ühendi laeng).
5 Leia ühendi laengust tundmatu oksüdatsiooniaste. Nüüd on teil kõik andmed soovitud oksüdatsiooniastme hõlpsaks arvutamiseks. Kirjutage võrrand, mille vasakul küljel on eelmises arvutusetapis saadud arvu ja tundmatu oksüdatsiooniastme summa ning paremal pool ühendi kogulaeng. Teisisõnu, (Teadaolevate oksüdatsiooniastmete summa) + (soovitud oksüdatsiooniaste) = (ühendi laeng).- Meie puhul Na2NII4 lahendus näeb välja selline:
- (Teadaolevate oksüdatsiooniastmete summa) + (soovitud oksüdatsiooniaste) = (ühendlaeng)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2NII4 väävlil on oksüdatsioon 6.
- Meie puhul Na2NII4 lahendus näeb välja selline:
Näpunäiteid
- Ühendites peab kõigi oksüdatsiooniastmete summa olema võrdne laenguga. Näiteks kui ühend on kahekohaline ioon, peab aatomite oksüdatsiooniastmete summa olema võrdne kogu ioonlaenguga.
- Väga kasulik on kasutada perioodilist tabelit ja teada, kus selles asuvad metallilised ja mittemetallilised elemendid.
- Aatomite oksüdatsiooniaste elementaarses vormis on alati null. Üksiku iooni oksüdatsiooniaste on võrdne selle laenguga. Perioodilise tabeli rühma 1A elementide, nagu vesinik, liitium, naatrium, elementaarsel kujul on oksüdatsiooniaste +1; Rühma 2A metallide, nagu magneesium ja kaltsium, oksüdatsiooniaste on elementaarsel kujul +2. Hapnikul ja vesinikul võib sõltuvalt keemilise sideme tüübist olla 2 erinevat oksüdatsiooniastet.
Mida sul vaja on
- Elementide perioodiline tabel
- Interneti -juurdepääs või keemia teatmeteosed
- Paberileht, pliiats või pliiats
- Kalkulaator