Autor:
Lewis Jackson
Loomise Kuupäev:
6 Mai 2021
Värskenduse Kuupäev:
1 Juuli 2024
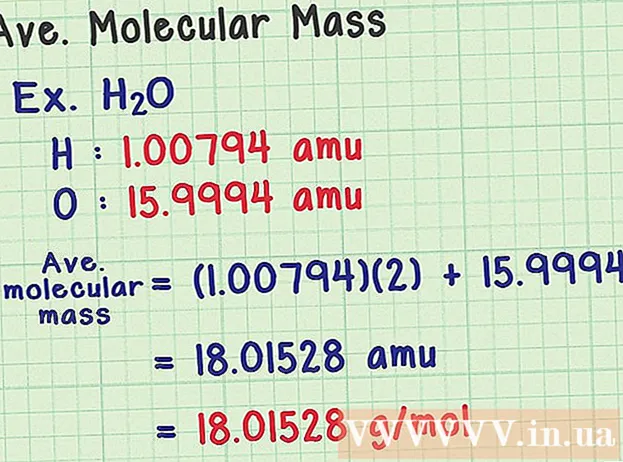
Sisu
Keskmine aatomi mass ei ole aatomi massi otsene mõõt. Selle asemel on see elemendi tüüpilise valimi keskmine mass aatomi kohta. Kui suudate mõõta miljardite üksikute aatomite masse, saate selle teada, arvutades nende keskmise. Meil on praktilisem meetod, mis põhineb teabel keemilise elemendi erinevate isotoopide kohta.
Sammud
1. osa 2-st: arvutage keskmine aatomi mass
Mõista isotoope ja massi aatomeid. Looduses eksisteerib enamik elemente mitmel kujul või isotoopidena. Ainus erinevus sama elemendi kahe isotoobi vahel on neutronite arv aatomis, mille neutronite arv mõjutab massi aatomit. Keskmise aatomi massi arvutamisel võetakse arvesse selle erinevuse mõju ja öeldakse iga aatomi keskmine mass nende aatomite proovis.
- Näiteks hõbeelementil (Ag) on kaks looduslikku isotoopi: Ag-107 ja Ag-109 (või Ag ja Ag). Isotoop on nimetatud "massinumbri" järgi ehk prootonite arvu ja aatomis neutronite arvu summa järgi. See tähendab, et Ag-109-l on veel kaks neutronit kui Ag-107-l, seega on selle aatom veidi raskem.

Leidke iga isotoobi mass. Iga isotoobi jaoks on vaja kahte teavet, saate neid otsida teatmeteostest või otsida veebis, näiteks webelements.com. Esimene on iga isotoobi massiaatom või aatommass. Rohkem neutronitega isotoopidel on suurem mass.- Näiteks hõbeda isotoopil Ag-107 on massi aatom 106,90509 amu (kuupmeetri aatomi ühik). Isotoob Ag-109 on veidi raskem massiga 108,90470.
- Kümnendkohtade paar võib dokumentides veidi erineda. Ärge kirjutage missa järel sulgudesse numbreid.

Pange kirja iga isotoobi looduslik ellujäämismäär. See suhe näitab isotoobi levimust protsendina elemendi kogu aatomitest. Selle teabe leiate samast dokumendist, millel on kuupmeetri aatom. Kõigi isotoopide looduslik ellujäämine peaks olema 100% (ehkki ümardamise vea tõttu võib see veidi erineda).- Ag-107 isotoobi suhe on 51,86%. Isotoop Ag-109 on vähem levinud kiirusega 48,14%. See tähendab, et tavalises hõbeproovis on 51,86% Ag-107 ja 48,14% Ag-109.
- Kõiki isotoope, millel seda ellujäämisprotsenti pole, eiratakse. Neid isotoope ei ole maa peal looduslikult olemas.

Teisendage isotoopide protsent kümnendarvuks. Jagades selle suhte 100-ga, saadakse sama väärtus kui koma.- Ülaltoodud hõbeproovis on isotoopide suhe 51,86 / 100 = 0,5186 ja 48,14 / 100 = 0,4814.
Leidke keskmine kuupmeetri aatom. Elemendi keskmine aatomi mass on n isotoopid võrdsed (Aatomiplokk1. isotoop * suhe1. isotoop) + (aatommass2. isotoop * suhe2. isotoop) + ... + (aatommassisotoopid n * suheisotoopid n. See on näide "keskmisest massist", mis tähendab, et mida suurem on isotoobi ellujäämismäär, seda suurem on selle mõju tulemusele. Selle valemi rakendamine hõbeda jaoks on järgmine:
- Keskmise massiga aatomAg = (massi aatomAg-107 * suheAg-107) + (aatommassAg-109 * suheAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Tulemuste kontrollimiseks leidke see element perioodilisustabelilt. Keskmine kuupmeetri aatom on alati kirjutatud elemendi keemilise sümboli alla.
- Keskmise massiga aatomAg = (massi aatomAg-107 * suheAg-107) + (aatommassAg-109 * suheAg-109)
2. osa 2: tulemuste kasutamine
Teisenda mass aatomnumbriks. Keskmine massi aatom näitab massi ja aatomi arvu suhet selle elemendi tüüpilises proovis. See on keemialaborites väga kasulik, kuna aatomeid on peaaegu võimatu täpselt lugeda, kuid masse on lihtne kindlaks määrata. Näiteks võite kaaluda hõbeproovi ja teada, et iga 107 8667 ammu kohta on üks hõbeda aatom.
Teisenda molaarmassiks. Aatommassiühik on väga väike, nii et keemikud kasutavad massi jaoks sageli grammiühikut. Õnneks on meil need mõisted määratletud, nii et ümberkujundamine peaks olema lihtne. Tulemuse g / mol saamiseks korrutage lihtsalt keskmine aatomi mass 1 g / mol (molaarmassikonstant). Näiteks 107 8667 grammi hõbedat sisaldab ühte mooli hõbeaatomit.
Leidke keskmine molekulmass. Kuna molekul on aatomite kogu, saate molekulmassi leidmiseks lisada kõigi aatomite massi. Kui kasutaksite keskmise massi aatomit (konkreetse isotoobi massi asemel), oleks tulemus looduses oleva proovi keskmine molekulmass. Siin on näide:
- Veemolekulil on keemiline valem H2O sisaldab kahte vesiniku aatomit (H) ja ühte hapniku (O) aatomit.
- Vesiniku keskmine aatomi mass on 1 00794 amu. Hapniku keskmine aatommass on 15 9994 amu.
- Niisiis on H keskmine molekulmass2O on võrdne (1,00794) (2) + 15,9994 = 18,01528 amu, mis võrdub 18,01528 g / mol.
Nõuanne
- Suhtelise aatommassi mõistet kasutatakse mõnikord keskmise massi aatomi sünonüümina. Siin on väike erinevus, kuna aatommass on suhteliselt ühikuna; see on massi mõõtmine süsinik-12 aatomi suhtes. Niikaua kui kasutate keskmise kuupmeetri aatomi arvutamisel aatommassiühikut, on need kaks väärtust samad.
- Kuup-aatomi järel sulgudes olev number ütleb meile vea. Näiteks tähendab massiaatom 1.0173 (4), et elemendi normaalaatomi massivahemik on umbes 1.0173 ± 0.0004. Kui seda ei küsita, ei pea te seda numbrit hankima.
- Perioodilisustabelis on järgmise elemendi keskmine kuupaatom suurem kui see, mis on enne seda, eranditeta. Siin on kiire viis tulemuste kontrollimiseks.
- 1 aatommassiühik on 1/12 süsinik-12 aatomi massist.
- Isotoopide ellujäämise määr arvutatakse tüüpiliste looduslikult esinevate proovide järgi maa peal. Mittelooduslikult esinevatel ainetel, näiteks meteoriitidel või laboris toodetud ainetel, võib olla erinev isotoobi suhe, seega on ka keskmine massi aatom erinev.
Hoiatus
- Massiaatomid kirjutatakse alati aatomi massiühikutes (amu või u), mida mõnikord nimetatakse ka daltoniteks (Da). Ärge kunagi kirjutage selle numbri järele teist massiühikut (näiteks kilogrammi) ilma seda muutmata.
Mida sa vajad
- Pliiats
- Paber
- Sülearvuti
- Andmed isotoopide ellujäämise määra kohta looduses.
- Isotoopide aatomiühikute massiandmed.