Autor:
Lewis Jackson
Loomise Kuupäev:
5 Mai 2021
Värskenduse Kuupäev:
1 Juuli 2024

Sisu
Mol on keemia standardne mõõtühik, mida kasutatakse ühendi erinevate elementide vaatlemiseks. Tavaliselt arvutatakse liitmass grammides (g) ja see tuleb teisendada molaarühikuteks. Üleminek on üsna lihtne, kuid siiski on veel mõned olulised sammud, mida peame järgima. Allpool toodud meetodit kasutades saate grammi hõlpsalt moolideks teisendada.
Sammud
Osa 1 2: Arvutage molekulmass
Valmistage matemaatikaülesande lahendamiseks vajalikud tarvikud ette. Kui kõik tööriistad on saadaval, on probleemi lahendamine lihtsam. Vaja on:
- Pliiats ja paber. Matemaatika muutub lihtsamaks, kui kirjutate kõik paberile. Maksimaalse punktisumma saavutamiseks peate esitama kõik etapid.
- Keemiliste elementide perioodiline tabel: kasutatakse elementide massi aatomite määramiseks.
- Taskukalkulaator: kasutatakse keeruliste arvude arvutamiseks.

Tehke kindlaks, millised elemendid on ühendis, mille peate teisendama molaarseteks ühikuteks. Molekulmassi arvutamise esimene samm on ühendi moodustavate elementide määramine. See on lihtne, kuna elementide lühend on ainult üks kuni kaks tähemärki.- Kui ainet lühendatakse kahe tähega, on esimene täht suurtähtedega ja teine täht väiketähega. Näide: Mg on elemendi magneesium lühend.
- NaHCO ühendid3 koosneb neljast elemendist: naatrium (Na), vesinik (H), süsinik (C) ja hapnik (O).
Määrake ühendi iga elemendi aatomite arv. Selle ühendi massimolekuli arvutamiseks peate teadma ühendi iga aine aatomnumbrit. Väike number elemendi lühendi kõrval tähistab elemendi aatomnumbrit.- Näide: ühend H2O-l on kaks vesiniku aatomit ja üks hapniku aatom.
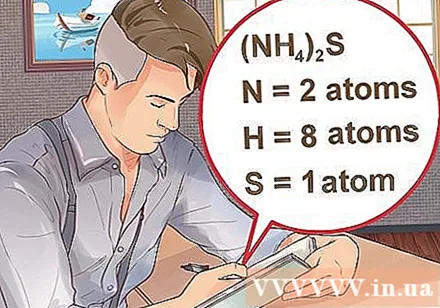
- Kui ühend kirjutatakse sulgudes koos väikese indeksiga, tähendab see, et iga sulgudes olev koostisosa korrutab indeksit. Näide: ühend (NH4)2S koosneb kahest N aatomist, kaheksast H aatomist ja ühest S aatomist.

Pange kirja iga elemendi kuupmeetri aatomipaber. Perioodilise tabeli kasutamine on lihtsaim viis elemendi kuupmeetri aatomi leidmiseks. Pärast elemendi paiknemist perioodilisustabelis näete aatommassi just elemendi ikooni all.- Näiteks on hapniku kuupmeetri aatom 15,99.
Arvutage molekulmass. Aine massimolekul on võrdne iga elemendi aatomite arvuga, korrutatuna selle elemendi massi aatomiga. See kogus on oluline grammides molaarseks muundamiseks.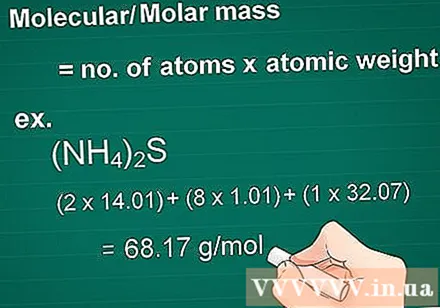
- Kõigepealt korrutage ühendi iga elemendi aatomnumber selle massi aatomiga.
- Seejärel lisage ühendis olevate elementide massid kokku.
- Näide: ühendi molekulmass (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- Molekulmass on tuntud ka kui molaarmass.
2. osa 2-st: teisendage gramm moliks
Seadistage teisendusvalem. Ühendi moolide arvu leidmiseks jagage ühendi grammide arv selle ühendi molaarmassiga.
- Valem: moolide arv = ühendi mass (grammides) / molaarmassis (gramm / mol)
Pange numbrid valemisse. Pärast õige valemi seadistamist on järgmine samm arvutatud arvude asendamine valemiga. Kui soovite veenduda, et andmed on õiges asendis, saate neid kontrollida, surudes seadme alla. Kui pärast lihtsust on järelejäänud ühikuks moolid, siis olete seadistatud õigesti.
Lahendage võrrand. Jagage kalkulaatori abil mass aine või ühendi kuupmeetri molekuliga. Koefitsiendiks on otsitava aine või ühendi moolide arv.
- Näiteks on probleem 2 g vees (H2O) ja palun teisendada see molaarühikuteks. Meil on H molaarmass2O on 18 g / mol. Jagage 2 18-ga, nii et teil on 0,1111 mol H2O.
Nõuanne
- Ärge unustage lisada vastustele elemendi või liitnime.
- Kui teil palutakse esitada mõni harjutus või viktoriin, näidake kindlasti oma vastused selgelt ringi, tõmmates vastuste ümber ringi või joonistades kasti.
Mida sa vajad
- Keemiline perioodilisustabel
- Pliiats
- Paber
- Arvuti
- Keemiaprobleemid