Autor:
Randy Alexander
Loomise Kuupäev:
25 Aprill 2021
Värskenduse Kuupäev:
26 Juunis 2024
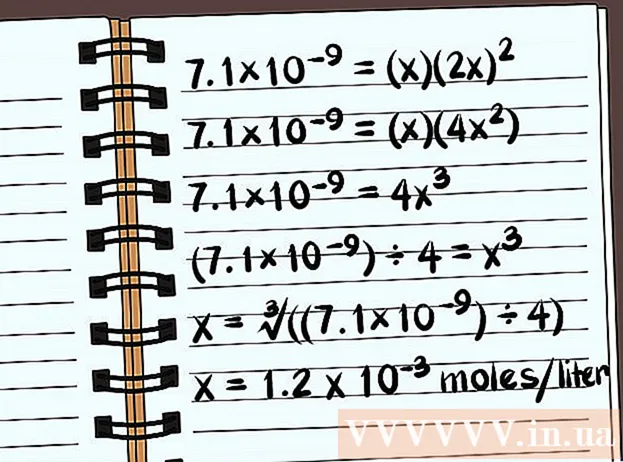
Sisu
Keemias kasutatakse tahke ühendi omaduste kirjeldamiseks lahustuvust, kui see lahustatakse täielikult vedelikus, jätmata lahustumatuid jääke. Lahustuvad ainult ioonsed ühendid (laetud). Tegelikult peate teadma, kas ioonne ühend jääb vette lisamisel tahkeks või kui suur kogus lahustub, peate ainult mõned reeglid meelde jätma või otsima kirjandust. Tegelikult lahustub teatud kogus molekule isegi siis, kui te ei näe muutusi, nii et katse täpseks saamiseks peate teadma, kuidas seda soluudi kogust arvutada.
Sammud
1. meetod 2-st: kasutage kiirreegleid
Lisateave ioonsete ühendite kohta. Igal aatomil on tavaliselt kindel arv elektrone, kuid mõnikord ta saab või annab elektroni ära. See protsess muudab selle üheks ioonid laetud. Kui negatiivse laenguga (ühe elektroni ülejääk) ioon kohtub positiivse laenguga (elektron puudub) iooniga, siis ühenduvad nad nagu kahe magneti katood ja anood. Tulemuseks on ioonne ühend.
- Ioonidel on negatiivne laeng anioonidja ioonidel on positiivne laeng katioon.
- Tavaliselt on elektronide arv aatomis võrdne prootonite arvuga, seega pole sellel laengut.

Mõista lahustuvust. Vee molekul (H2O) on ebakorrapärase struktuuriga, nii et see sarnaneb magnetiga: ühel otsal on positiivne ja teisel negatiivne laeng. Kui panete ioonse ühendi vette, kogunevad need vee "magnetid" selle ümber, püüdes positiivseid ja negatiivseid ioone lahku tõmmata.- Mõned ioonsed ühendid ei imendu väga tihedalt, neid arvestatakse lahustuv Sest see eraldub ja lahustub vette lisamisel. Teistel ühenditel on tugevamad sidemed lahustumatu kuna ioonid on üksteisega tihedalt tõmbunud, olenemata veemolekuli külgetõmbest.
- Mõnel ühendil on seondumisjõud, mis on võrdne veemolekuli ligitõmbavusega. Neid peetakse kergelt lahustuv sest enamus ühendeid eraldatakse, kuid ülejäänud tõmbuvad ikkagi üksteise poole.

Mõista lahustumise põhimõtet. Kuna aatomite vastastikmõjud on nii keerulised, ei saa te tugineda täielikult intuitsioonile, et eristada, milliseid ühendeid saab või mitte. Otsige allpool olevas loendis olevast ühendist esimest iooni selle ühiste omaduste osas, seejärel kontrollige erandeid, veendumaks, et teine ioon ei suhtle sellega ebaharilikult.- Näiteks strontsiumkloriidi (SrCl2), palun otsige Sr või Cl allpool olevatest paksudest sammudest. Cl on "tavaliselt lahustuv", seega kontrollige selle all olevaid erandeid. Sr pole erandite loendis, seega SrCl2 peab olema lahustuv.
- Iga reegli kõige tavalisemad erandid on kirjutatud reegli alla. On ka muid erandeid, kuid tõenäoliselt ei esine neid normaalse keemia või labori ajal.

Ühendid on lahustuvad, kui need sisaldavad leelismetalle nagu Li, Na, K, Rb ja Cs. Neid metalle tuntakse ka kui IA rühma elemente: liitium, naatrium, kaalium, rubiidium ja tseesium. Peaaegu kõik ühte neist ioonidest sisaldavad ühendid on lahustuvad.- Erand: Li3PO4 lahustumatu.
MITTE ühendeid3, C2H3O2, EI2, ClO3 ja ClO4 on kõik lahustuvad. Ülaltoodud ioonidele vastavad nimetused on nitraat, atsetaat, nitrit, kloraat ja perkloraat. Pange tähele, et atsetaati lühendatakse sageli kui OAc.
- Erand: Ag (OAc) (hõbeatsetaat) ja Hg (OAc)2 (elavhõbeda atsetaat) lahustumatu.
- AgNO2 ja KClO4 ainult "kergelt sulanud".
Cl, Br ja I ühendid on tavaliselt lahustuvad. Kloriidi-, bromiidi- ja jodiidiioonid moodustavad peaaegu alati lahustuvad ühendid, mida nimetatakse halogeensooladeks.
- Erand: Kui mõni ülaltoodud ioonidest on ühendatud hõbeioonidega Ag, on elavhõbe Hg2või Pb plii moodustavad lahustumatuid ühendeid. Sama kehtib ka vähem levinud ühendite kohta, mis moodustuvad koos vase Cu ja tali Tl-ga.
SO-d sisaldavad ühendid4 tavaliselt lahustuv. Sulfaatioonid moodustavad sageli lahustuvaid ühendeid, kuid on palju erandeid.
- Erand: Sulfaatioonid moodustavad lahustumatuid ühendeid järgmiste ioonidega: strontsium Sr, baarium Ba, plii Pb, hõbe Ag, kaltsium Ca, raadium Ra ja Ag hõbe aatomid2. Pange tähele, et hõbesulfaat ja kaltsiumsulfaat lahustuvad vaid mõõdukalt, mistõttu mõned peavad neid kergelt lahustuvaks.
OH või S sisaldavad ained on lahustumatud. Nende ioonide vastavad nimed on hüdroksiidid ja sulfiidid.
- Erand: Kas mäletate leelismetalle (rühmad I-A) ja kuidas neile meeldib moodustada lahustuvaid ühendeid? Li, Na, K, Rb ja Cs moodustavad kõik ühendid, mis lahustuvad hüdroksiidi või sulfiidi ioonidega. Lisaks moodustavad hüdroksiidid soolad, mis lahustuvad leelismuldmetallide ioonidega (rühm II-A): kaltsium Ca, strontsium Sr ja baarium Ba. Märkus: hüdroksiididest ja leelismuldmetallidest valmistatud ühenditel on tõepoolest märkimisväärne arv molekule, mis jäävad omavahel seotud, mistõttu neid peetakse mõnikord "kergelt lahustuvateks".
CO-d sisaldavad ühendid3 või PO4 lahustumatu. Kontrollige veel viimast korda karbonaadi ja fosfaadi ioonide olemasolu ning näete, kas teie ühend on lahustuv.
- Erand: Need ioonid moodustavad ühendid, mis lahustuvad leelismetallidega nagu Li, Na, K, Rb ja Cs, samuti ammooniumiooniga NH4.
Meetod 2/2: arvutage lahustuvus konstandi K järgisp
Otsige üles lahustuvusprodukti konstant Ksp. See konstant on iga ühendi jaoks erinev, nii et peaksite seda otsima graafikust õpikus või veebis. Kuna need väärtused määratakse katseliselt ja need võivad graafikute vahel oluliselt erineda, on kõige parem kasutada õpikute graafikut, kui see on saadaval. Kui pole täpsustatud teisiti, eeldatakse enamikul proovitükkidel katsetemperatuuri 25 ° C.
- Oletame näiteks, et lahustate pliijodiidi valemiga PbI2kirjutage selle lahustuvuse korrutis konstantseks. Kui viidate graafikule aadressil bilbo.chm.uri.edu, siis kasutate konstanti 7,1 × 10.
Kirjutage keemiline võrrand. Esiteks määratakse selle ühendi iooniline eraldusmuster lahustumisel. Seejärel kirjutage võrrand K-gasp ühel ja komponentioonid teisel küljel.
- Näiteks PbI molekul2 dissotsieeruvad ioonideks Pb, I ja I. (Peate ainult teadma või kontrollima iooni laengut, kuna kõik ühendid on alati elektriliselt neutraalsed).
- Kirjutage võrrand 7,1 × 10 =
- See võrrand on lahustuvuskonstant, selle saate teada 2 iooni kohta lahustuvustabelis. Kuna l- ioone on 2, peab l- olema ruut.
Muutujate kasutamiseks teisendage võrrandid. Kirjutage võrrand uuesti tavaliste algebraliste meetodite abil, kasutades teavet, mida teate molekulide ja ioonide arvu kohta. Määrake x lahustamiseks vajaliku ühendi massiga ja kirjutage võrrand, kus x tähistab iga iooni arvu, uuesti.
- Selles näites peame valemi 7,1 × 10 = ümber kirjutama
- Kuna ühendis on ainult üks pliiioon (Pb), on lahustunud molekulide arv võrdne vabade pliiioonide arvuga. Seega saame selle seada väärtuseks x.
- Kuna iga pliiiooni kohta on kaks joodiiooni (I), määrasime joodi aatomite arvu 2x.
- Nüüd saab võrrandist 7,1 × 10 = (x) (2x)
Võtke arvesse tavalisi ioone, kui neid on. Jätke see samm vahele, kui lahustate ühendit destilleeritud vees. Kui ühend lahustatakse lahuses, milles on juba üks või mitu komponendi iooni ("tavalised ioonid"), väheneb ühendi lahustuvus märkimisväärselt. Üldioonide mõju on kõige ilmsem peaaegu lahustumatutele ühenditele ja sel juhul võite eeldada, et enamus ioonidest on tasakaalus need, mis olid varem lahuses. Kirjutage võrrand uuesti, et arvutada lahuses juba olevate ioonide molaarne kontsentratsioon (mol liitri kohta või M), asendades selle väärtuse muutujaga x, mida kasutate selle iooni jaoks.
- Näiteks kui pliijodiidi ühend lahustatakse 0,2 M pliikloriidi (PbCl) lahuses2), kirjutame võrrandi ümber järgmiselt: 7,1 × 10 = (0,2M + x) (2x). Kuna 0,2 M on suurem kontsentratsioon kui x, võiksime selle ümber kirjutada väärtusele 7,1 × 10 = (0,2 M) (2x).
Lahendage võrrand. Lahendage x ja näete ühendi lahustuvust. Lahustuvuskonstandi definitsioonis peate kirjutama oma vastuse lahustunud ühendite moolide arvu kohta liitri vee kohta. Võimalik, et peate lõpliku vastuse leidmiseks kasutama arvutit.
- Järgmine näide on lahustuvus destilleeritud vees ilma ühiste ioonideta.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 mooli liitri kohta lahustub. See on väga väike mass, nii et see ühend on peaaegu lahustumatu.
Mida sa vajad
- Ühendi lahustuvusproduktide konstantide tabel (Ksp)
Nõuanne
- Kui teil on eksperimentaalsed andmed lahustunud ühendite koguse kohta, võite lahustuvuskonstandi K lahendamiseks kasutada sama võrrandit.sp.
Hoiatus
- Nende mõistete määratluste osas pole üksmeelt, kuid keemikud nõustuvad enamikus ühendites. Mitmed spetsiaalsed ühendid, milles nii lahustuvad kui ka lahustumatud molekulid moodustavad olulised koostisosad, millel kõigil on nende ühendite erinev kirjeldus.
- Mõnes vanas õpikus on näha NH-d4OH on lahustuv ühend. See ei ole tõsi; Avastati väikesed NH-ioonide kogused4 ja OH, kuid need kaks iooni ei saa ühendiks ühendada.