Autor:
Frank Hunt
Loomise Kuupäev:
16 Märts 2021
Värskenduse Kuupäev:
27 Juunis 2024
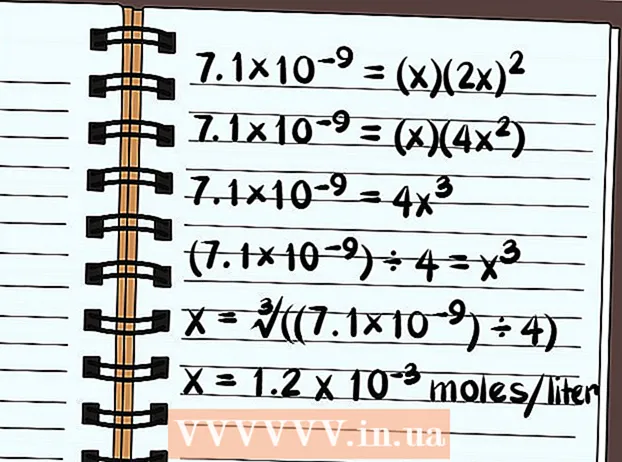
Sisu
- Astuda
- 1. meetod 2-st: kiirreeglite kasutamine
- 2. meetod 2-st: K. lahustuvuse arvutaminesp
- Vajadused
- Näpunäited
- Hoiatused
Keemias kasutatakse lahustuvust, et kirjeldada tahke aine omadusi, mis on segatud ja täielikult lahustunud vedelikus, jätmata lahustamata osakesi. Lahustuvad ainult (laetud) ioonsed ühendid. Praktilistel eesmärkidel piisab mõne reegli meeldejätmisest või reeglite loendi vaatamisest, et öelda, kas enamik ioonseid ühendeid jääb veega segatuna tahkeks või lahustub märkimisväärne kogus. Tegelikult lahustuvad mõned molekulid isegi siis, kui te ei näe muutusi, nii et täpsete katsete jaoks peate teadma, kuidas seda kogust arvutada.
Astuda
1. meetod 2-st: kiirreeglite kasutamine
 Tea rohkem ioonsete ühendite kohta. Igal aatomil on tavaliselt mitu elektroni, kuid mõnikord nad saavad või kaotavad ühe ekstra elektroni. Tulemus on üks ioon elektrilaenguga. Kui negatiivse laenguga ioon (lisaelektron) kohtub positiivse laenguga iooniga (elektron puudub), ühenduvad nad omavahel, täpselt nagu kahe magneti negatiivne ja positiivne ots. Tulemuseks on iooniline side.
Tea rohkem ioonsete ühendite kohta. Igal aatomil on tavaliselt mitu elektroni, kuid mõnikord nad saavad või kaotavad ühe ekstra elektroni. Tulemus on üks ioon elektrilaenguga. Kui negatiivse laenguga ioon (lisaelektron) kohtub positiivse laenguga iooniga (elektron puudub), ühenduvad nad omavahel, täpselt nagu kahe magneti negatiivne ja positiivne ots. Tulemuseks on iooniline side. - Negatiivse laenguga ioone nimetatakse anioonidja positiivse laenguga ioonid katioonid.
- Tavaliselt võrdub elektronide arv aatomis prootonite arvuga, kus elektrilaengud on tasakaalus.
 Tea lahustuvust. Veemolekulid (H.2O) on ebatavalise struktuuriga, millega nad käituvad nagu magnet: ühel otsal on positiivne laeng, teisel aga negatiivselt. Kui segate ioonse sideme veega, kogunevad need "veemagnetid" selle ümber, püüdes lahutada positiivseid ja negatiivseid ioone. Mõned ioonsidemed ei ole üksteisega eriti tihedad; need on lahustuvsest vesi rebeneb ja lahustab sideme. Teistel komposiitidel on tugevamad sidemed ja on Pole lahendatavkuna nad võivad veemolekulidest hoolimata kokku jääda.
Tea lahustuvust. Veemolekulid (H.2O) on ebatavalise struktuuriga, millega nad käituvad nagu magnet: ühel otsal on positiivne laeng, teisel aga negatiivselt. Kui segate ioonse sideme veega, kogunevad need "veemagnetid" selle ümber, püüdes lahutada positiivseid ja negatiivseid ioone. Mõned ioonsidemed ei ole üksteisega eriti tihedad; need on lahustuvsest vesi rebeneb ja lahustab sideme. Teistel komposiitidel on tugevamad sidemed ja on Pole lahendatavkuna nad võivad veemolekulidest hoolimata kokku jääda. - Mõnel ühendusel on sisemised sidemed, mille tugevus on võrreldav vee tõmbega. Need ained on mõõdukalt lahustuv, sest märkimisväärne osa (kuid mitte kõik) võlakirjadest tõmmatakse lahti.
 Uurige lahustuvuse reegleid. Kuna aatomite vastastikune mõju on üsna keeruline, pole alati intuitiivne, millised ühendid on lahustuvad ja lahustumatud. Leidke ühendi esimene ioon allpool olevast loendist, et teada saada, kuidas see tavaliselt käitub, seejärel kontrollige erandeid veendumaks, et teine ioon ei reageeri ebaharilikult.
Uurige lahustuvuse reegleid. Kuna aatomite vastastikune mõju on üsna keeruline, pole alati intuitiivne, millised ühendid on lahustuvad ja lahustumatud. Leidke ühendi esimene ioon allpool olevast loendist, et teada saada, kuidas see tavaliselt käitub, seejärel kontrollige erandeid veendumaks, et teine ioon ei reageeri ebaharilikult. - Näiteks strontsiumkloriidi (SrCl2), otsige allpool näidatud paksude sammudega Sr või Cl. Cl on "enamasti lahendatav", nii et kontrollige allpool toodud erandeid. Sr pole erandina märgitud, seega SrCl2 olema lahustuv.
- Allpool on loetletud kõige tavalisemad erandid igast reeglist. On ka muid erandeid, kuid tõenäoliselt ei leia neid ühises keemiatunnis või laboris.
 Ühendid on lahustuvad, kui need sisaldavad leelismetalle, sealhulgas Li, Na, K, Rb ja Cs. Neid nimetatakse ka IA rühma elementideks: liitium, naatrium, kaalium, rubiidium ja tseesium. Peaaegu kõik ühendid nende ioonidega on lahustuvad.
Ühendid on lahustuvad, kui need sisaldavad leelismetalle, sealhulgas Li, Na, K, Rb ja Cs. Neid nimetatakse ka IA rühma elementideks: liitium, naatrium, kaalium, rubiidium ja tseesium. Peaaegu kõik ühendid nende ioonidega on lahustuvad. - Erand: Li3PO4 ei ole lahustuv.
 Ühendid NO-ga3, C2H.3O2, EI2, ClO3 ja ClO4 on lahustuvad. Need on vastavalt nitraadi, atsetaadi, nitriti, kloraadi ja perkloraadi ioonid. Pange tähele, et atsetaati lühendatakse sageli OAc-ga.
Ühendid NO-ga3, C2H.3O2, EI2, ClO3 ja ClO4 on lahustuvad. Need on vastavalt nitraadi, atsetaadi, nitriti, kloraadi ja perkloraadi ioonid. Pange tähele, et atsetaati lühendatakse sageli OAc-ga. - Erandid: Ag (OAc) (hõbeatsetaat) ja Hg (OAc)2 (elavhõbeda atsetaat) ei lahustu.
- AgNO2 ja KClO4 on ainult "osaliselt lahustuvad".
 Cl, Br ja I ühendid on tavaliselt lahustuvad. Kloriidi-, bromiidi- ja jodiidiioonid moodustavad peaaegu alati lahustuvad ühendid, mida nimetatakse ka halogeensooladeks.
Cl, Br ja I ühendid on tavaliselt lahustuvad. Kloriidi-, bromiidi- ja jodiidiioonid moodustavad peaaegu alati lahustuvad ühendid, mida nimetatakse ka halogeensooladeks. - Erand: Kui kumbki neist seondub hõbe (Ag), elavhõbeda (Hg2) või plii (Pb), tulemus ei lahustu. Sama kehtib ka vähem levinud vase (Cu) ja talliumi (Tl) ühendite kohta.
 Ühendused SO-ga4 on tavaliselt lahustuvad. Sulfaatioon moodustab tavaliselt lahustuvaid ühendeid, kuid on mitmeid erandeid.
Ühendused SO-ga4 on tavaliselt lahustuvad. Sulfaatioon moodustab tavaliselt lahustuvaid ühendeid, kuid on mitmeid erandeid. - Erandid: Sulfaatioon moodustab lahustumatuid ühendeid järgmiste ioonidega: strontsium Sr, baarium Ba, plii Pb, hõbe Ag, kaltsium Ca, raadium Ra ja diatoomne hõbe Ag2. Pange tähele, et hõbesulfaat ja kaltsiumsulfaat lahustuvad täpselt nii palju, et neid võib mõnikord nimetada vähe lahustuvateks.
 OH või S ühendid ei ole lahustuvad. Need on vastavalt hüdroksiidi ja sulfiidi ioonid.
OH või S ühendid ei ole lahustuvad. Need on vastavalt hüdroksiidi ja sulfiidi ioonid. - Erandid: Kas mäletate leelismetalle (rühm I-A) ja kui palju neile meeldib lahustumatuid ühendeid moodustada? Li, Na, K, Rb ja Cs moodustavad kõik lahustuvad ühendid hüdroksiidi või sulfiidi ioonidega. Lisaks moodustab hüdroksiid leelismuldmetallide (rühm II-A) ioonidega lahustuvad soolad: kaltsium Ca, strontsium Sr ja baarium Ba. Pange tähele, et leelismuldmetalli ühendiga hüdroksiidil on täpselt nii palju molekule, et need kokku kleepuksid, et seda saaks mõnikord pidada "vähe lahustuvaks".
 Ühendid CO-ga3 või PO4 ei ole lahustuvad. Kontrollige veel viimast korda karbonaadi- ja fosfaadiioonide olemasolu ning peaksite teadma, mida ühendilt oodata.
Ühendid CO-ga3 või PO4 ei ole lahustuvad. Kontrollige veel viimast korda karbonaadi- ja fosfaadiioonide olemasolu ning peaksite teadma, mida ühendilt oodata. - Erandid: Need ioonid moodustavad lahustuvad ühendid tavaliste ainete, leelismetallide Li, Na, K, Rb ja Cs, samuti ammoonium-NH-ga.4.
2. meetod 2-st: K. lahustuvuse arvutaminesp
 Otsige konstandi K lahustuvusprodukt.sp. See konstant on iga ühenduse jaoks erinev, nii et peate selle otsima oma õpiku tabelist või veebis. Kuna need väärtused määratakse katseliselt, võivad need tabeliti olla väga erinevad, seega on kõige parem kasutada tabelit oma õpikus, kui see on olemas. Kui pole öeldud teisiti, eeldatakse enamikus tabelites ümbritseva õhu temperatuuri 25 ° C.
Otsige konstandi K lahustuvusprodukt.sp. See konstant on iga ühenduse jaoks erinev, nii et peate selle otsima oma õpiku tabelist või veebis. Kuna need väärtused määratakse katseliselt, võivad need tabeliti olla väga erinevad, seega on kõige parem kasutada tabelit oma õpikus, kui see on olemas. Kui pole öeldud teisiti, eeldatakse enamikus tabelites ümbritseva õhu temperatuuri 25 ° C. - Näiteks kui soovite pliijodiidi (PbI2), kirjutage üles lahustuvusprodukti tasakaalukonstant. Kui kasutate tabelit saidil bilbo.chm.uri.edu, kasutage konstanti 7,1 × 10.
 Kõigepealt kirjutage keemiline võrrand. Kõigepealt tehke kindlaks, kuidas ühend laguneb ioonideks. Nüüd kirjutage võrrand K-ga.sp ühelt poolt ja teiselt poolt üksikud ioonid.
Kõigepealt kirjutage keemiline võrrand. Kõigepealt tehke kindlaks, kuidas ühend laguneb ioonideks. Nüüd kirjutage võrrand K-ga.sp ühelt poolt ja teiselt poolt üksikud ioonid. - Näiteks PbI molekul2 jaguneb ioonideks Pb, I ja teiseks I (peate teadma või otsima ainult ühe iooni laengut, sest teate, et koguühendil on alati neutraalne laeng).
- Kirjutage võrrand 7,1 × 10 = [Pb] [I]
 Muutujate kasutamiseks kohandage võrrandit. Kirjutage võrrand ümber ühe algebraülesandena, kasutades oma teadmisi molekulide või ioonide arvu kohta. Pange x võrdseks lahustuva aine kogusega ja kirjutage muutujad ümber iga iooni arvudena.
Muutujate kasutamiseks kohandage võrrandit. Kirjutage võrrand ümber ühe algebraülesandena, kasutades oma teadmisi molekulide või ioonide arvu kohta. Pange x võrdseks lahustuva aine kogusega ja kirjutage muutujad ümber iga iooni arvudena. - Meie näites kirjutame ümber 7,1 × 10 = [Pb] [I]
- Kuna ühendis on ainult üks pliiioon (Pb), on lahustunud ühendi molekulide arv võrdne vabade pliiioonide arvuga. Nii saame [Pb] asendada x-ga.
- Kuna iga pliiiooni kohta on kaks joodi iooni (I), võime võrdsustada joodi aatomite arvu 2x.
- Võrrand loeb nüüd 7,1 × 10 = (x) (2x)
 Mõelge tavalistele ioonidele, kui neid on. Jätke see samm vahele, kui lahustate ühendit puhtas vees. Kui ühend aga lahustatakse lahuses, mis sisaldab juba ühte või mitut koostisosast koosnevat iooni ("tavaline ioon"), väheneb lahustuvus märkimisväärselt. Tavaliste ioonide mõju on kõige märgatavam ühendites, mis on enamasti lahustumatud, ja nendel juhtudel võib eeldada, et valdav enamus tasakaalus olevatest ioonidest pärineb lahuses juba olevast ioonist. Kirjutage võrrand juba teadaolevas lahuses sisalduvate ioonide teadaoleva molaarkontsentratsiooniga (moolid liitri kohta või M), asendades selle iooni jaoks kasutatud x väärtuse.
Mõelge tavalistele ioonidele, kui neid on. Jätke see samm vahele, kui lahustate ühendit puhtas vees. Kui ühend aga lahustatakse lahuses, mis sisaldab juba ühte või mitut koostisosast koosnevat iooni ("tavaline ioon"), väheneb lahustuvus märkimisväärselt. Tavaliste ioonide mõju on kõige märgatavam ühendites, mis on enamasti lahustumatud, ja nendel juhtudel võib eeldada, et valdav enamus tasakaalus olevatest ioonidest pärineb lahuses juba olevast ioonist. Kirjutage võrrand juba teadaolevas lahuses sisalduvate ioonide teadaoleva molaarkontsentratsiooniga (moolid liitri kohta või M), asendades selle iooni jaoks kasutatud x väärtuse. - Näiteks kui meie pliijoodühend lahustati 0,2 M pliikloriidi (PbCl2), siis võime võrrandi ümber kirjutada kui 7,1 × 10 = (0,2M + x) (2x). Ja siis, kuna 0,2 M on nii kõrge kontsentratsioon kui x, võime selle ohutult ümber kirjutada kui 7,1 × 10 = (0,2 M) (2x).
 Lahendage võrrand. Lahendage x ja teadke, kui lahustuv on ühend. Lahustuvuskonstandi määratlemisviisi tõttu väljendatakse teie vastust lahustunud ühendi moolide arvuna liitri vee kohta. Lõpliku vastuse leidmiseks võib vaja minna kalkulaatorit.
Lahendage võrrand. Lahendage x ja teadke, kui lahustuv on ühend. Lahustuvuskonstandi määratlemisviisi tõttu väljendatakse teie vastust lahustunud ühendi moolide arvuna liitri vee kohta. Lõpliku vastuse leidmiseks võib vaja minna kalkulaatorit. - Järgnev kehtib lahustuvuse kohta puhtas vees, mitte ühiste ioonidega.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = Lahustub 1,2 x 10 mooli liitri kohta. See on väga väike kogus, nii et teate, et see ühend on põhimõtteliselt halvasti lahustuv.
Vajadused
- Lahustuvusproduktide konstantide tabel (K.sp) ühenduste jaoks.
Näpunäited
- Kui teil on katsetest saadud andmeid ühendi lahustumise astme kohta, saate sama võrrandi abil lahendada lahustuvuskonstand Ksp.
Hoiatused
- Nende mõistete üldtunnustatud määratlus puudub, kuid keemikud nõustuvad enamikus ühendites. Mõningaid marginaalseid juhtumeid ühendite kohta, milles on märkimisväärne osa lahustunud ja lahustamata molekulidest, võib kirjeldada erinevate lahustuvustabelitega.
- Mõni vanem õpik annab NH-d4OH jälle lahustuva koostisena. See on vale; väikestes kogustes NH4 ja OH ioone võib täheldada, kuid neid ei saa ühendi saamiseks eraldada.



